Atualizações no Manejo de Síndrome do Desconforto Respiratório Agudo
A síndrome do desconforto respiratório agudo (SDRA) é uma condição de alta mortalidade e o manejo consiste em suporte e prevenção da evolução de injúria pulmonar. Em janeiro de 2024, a American Thoracic Society (ATS) atualizou sua diretriz sobre manejo de SARA e resumimos as principais recomendações neste tópico [1].
Mecânica pulmonar e consequências de SDRA
Neste tópico, vamos falar sobre o manejo de SDRA. Para definições de SDRA veja também o tópico “Nova Definição de Síndrome do Desconforto Respiratório Agudo (SDRA)”.
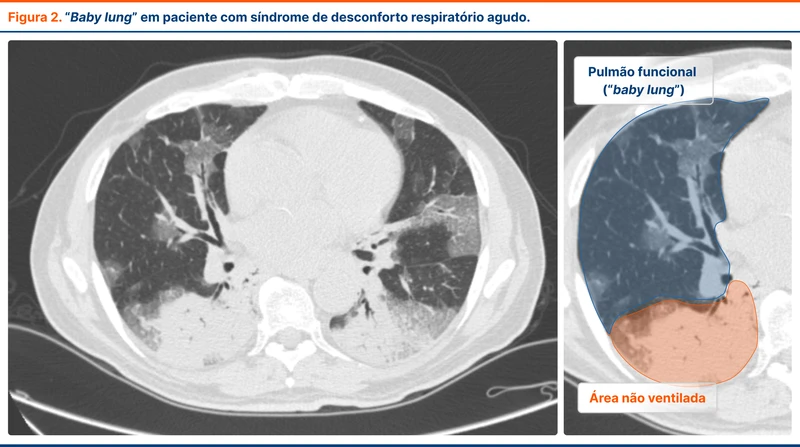
A SDRA é uma consequência de dano alveolar difuso por inflamação. Este dano leva ao preenchimento dos alvéolos por conteúdo inflamatório, principalmente em áreas do pulmão mais próximas do solo - áreas gravitacionais dependentes, que sustentam o peso do pulmão que está mais distante do solo. O preenchimento alveolar progressivo deixa menos alvéolos passíveis de aeração, gerando um pulmão funcionalmente menor do que o estimado para o paciente. Para ilustrar esse processo, diz-se que o paciente adulto com SDRA acaba tendo um pulmão de bebê, um "Baby Lung" (veja figura 1). A ideia do baby lung embasa o manejo do paciente com SDRA.
Alguns parâmetros da mecânica respiratória orientam o manejo de SDRA (veja figura 2):
- Complacência - quando aplicado a fisiologia pulmonar, esse termo significa a capacidade do pulmão expandir e acomodar mais ar. Um pulmão pouco complacente aumenta rapidamente a pressão à medida que mais ar entra, ou seja, é um pulmão duro, que não aceita muito ar. A SDRA causa redução da complacência pulmonar, já que apenas uma fração do pulmão (baby lung) terá que lidar com todo o volume de ar. A complacência é calculada dividindo o volume corrente pela driving pressure.
- Driving pressure (ou pressão de distensão) - é a pressão gerada pela distensão dos alvéolos com um determinado volume corrente. É calculada subtraindo a pressão de platô pelo valor da PEEP (pressão expiratória final positiva).
- Pressão de platô - é a pressão pulmonar aferida durante a realização de uma pausa inspiratória. Na pausa inspiratória, o fluxo de ar é zerado, e a pressão medida é uma consequência da complacência pulmonar. Se a complacência for baixa, a pressão de platô será alta.
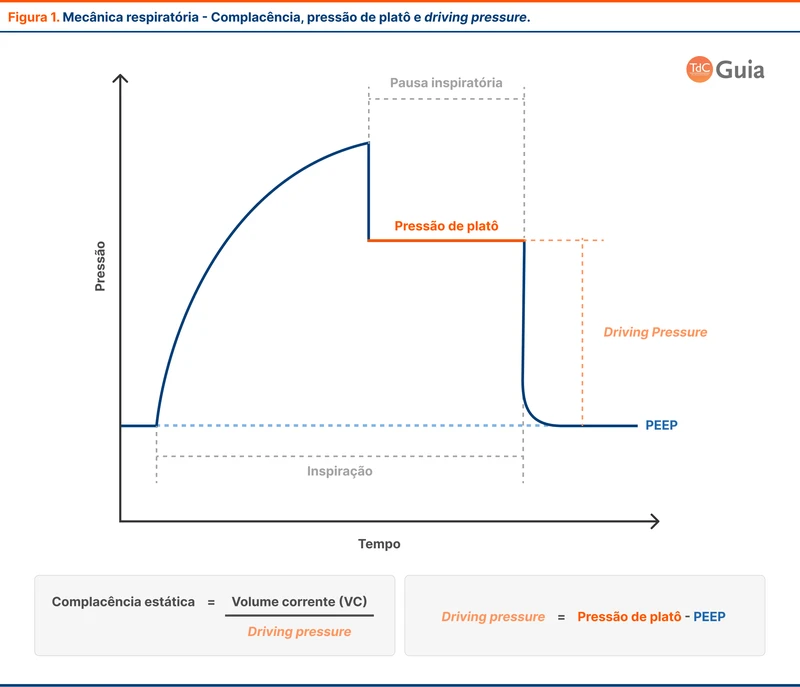
O preenchimento alveolar e a redução do tamanho funcional do pulmão diminuem a complacência pulmonar. Quanto mais grave o processo inflamatório pulmonar, menor a complacência.
Recomendações fortes - Ventilação protetora e posição prona
Ventilação protetora
A estratégia de ventilação protetora foi estabelecida pelo estudo ARMA em 2000. A diretriz mantém essa medida como recomendação forte para todos os pacientes com SARA, independente da relação PaO2/FiO2 [2].
Levando em consideração um pulmão funcionalmente reduzido, a ventilação protetora utiliza baixos volumes de ar para gerar menos pressão no pulmão. O volume utilizado nessa estratégia é baseado no peso predito do paciente. A recomendação é de utilizar 6 mL/kg de peso predito, podendo variar de 4 a 8 mL/kg. O objetivo é manter uma pressão de platô menor ou igual a 30 cmH2O.
Uma consequência do uso de volumes menores é a hipercapnia. A elevação dos níveis de pCO2 pode ser tolerada até um pH de 7,2 (hipercapnia permissiva).
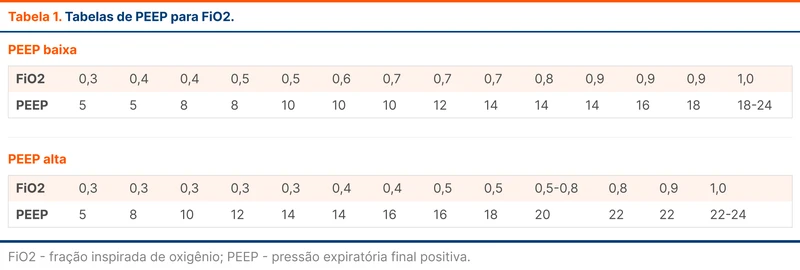
O estudo ARMA utilizou uma tabela de ajuste de PEEP para FiO2 com valores baixos (tabela 1). Recomenda-se o uso inicial de PEEP menores (entre 5 e 6 cmH2O) e titular posteriormente conforme a tabela, desde que mantenha-se a proteção pulmonar com a pressão de platô dentro da meta ao escalonar a PEEP.
Atualmente há evidências de que manter a driving pressure abaixo de 15 cmH2O também pode reduzir mortalidade, principalmente em pacientes mais graves (relação PaO2/FiO2 < 150) [3].
Posição prona
A posição prona é recomendada em pacientes que mantêm uma relação PaO2/FiO2 < 150 com FiO2 ≥ 60% após 12 a 24 horas de estabilização com ventilação protetora.
O estudo PROSEVA mostrou benefício de mortalidade para a posição prona e teve uma média de 17 horas de prona por dia [4]. Há uma preferência por tempos mais prolongados de prona, principalmente mais que 16 horas [4]. Alguns pacientes podem não demonstrar sinais de resposta nas primeiras 6 horas, porém respondendo após esse período [5].
Parâmetros de proteção pulmonar (driving pressure e pressão de platô) devem ser monitorizados em conjunto de parâmetros de oxigenação durante a prona. Indicadores de resposta durante a posição prona são a melhora da oxigenação com parâmetros ventilatórios estáveis ou melhora da pressão de platô com um volume corrente estável.
No estudo PROSEVA, as sessões de prona eram interrompidas se:
- Melhora persistente dos parâmetros durante posição supina (P/F ≥150 mmHg, FiO2 ≤60%, PEEP ≤10 cmH2O) OU
- Piora de mais de 20% na relação pO2/FiO2 durante a prona OU
- Complicações como instabilidade hemodinâmica ou outras que geram dano ao paciente.
Recomendações fracas - Bloqueio neuromuscular, PEEP alta, corticoide e ECMO
Bloqueio neuromuscular
O documento deixa como recomendação fraca o uso de bloqueador neuromuscular (BNM) precoce (primeiras 24 horas) em pacientes com SDRA grave (pO2/FiO2 < 100). A diretriz da European Society of Intensive Care Medicine (ESICM) de 2023 é divergente e não recomenda o uso rotineiro em pacientes com SARA e relação P/F < 150 [6].
A recomendação fraca vem de resultados conflitantes dos dois principais estudos sobre o assunto. O estudo ACURASYS de 2010 e o ROSE de 2019 randomizaram pacientes com SDRA e relação pO2/FiO2 < 150 mmHg para uso de BNM precoce versus placebo [7, 8].
O ACURASYS encontrou benefício de mortalidade com o uso de BNM, principalmente em pacientes com relação pO2/FiO2 < 120. Uma crítica foi que o grupo controle apresentou níveis de sedação profunda, o que pode ter predisposto a maior ocorrência de assincronias e maior mortalidade. Isso pode ser um viés que favoreceu o BNM. Já no ROSE, em que o grupo placebo era mantido em sedação leve, não houve diferença de mortalidade e o estudo foi parado precocemente por futilidade.
Atualmente, sabe-se que o uso excessivo de sedativos pode aumentar o risco de assincronias como disparo reverso e duplo disparo, o que associa-se com maior mortalidade na ventilação mecânica. A tendência de uso dos BNM precoce vem sendo individualizada para pacientes mais graves, mas que apresentam riscos elevados de lesão pulmonar induzida pela ventilação (pacientes com assincronias ou com sinais de aumento do esforço respiratório).
PEEP alta
A diretriz recomenda o uso de PEEP alta em contraponto à PEEP baixa em pacientes com SARA moderada e grave (P/F < 200 mmHg), com grau de recomendação fraca. Há uma tendência de melhora de sobrevida e redução do tempo de ventilação mecânica com o uso de PEEP alta, apesar de esse achado não ser consistente entre as revisões sistemáticas [9, 10].
Deve-se considerar dois pontos com o uso de PEEP alta:
- Não se sabe a melhor estratégia para aplicação da PEEP alta. Uma possibilidade é o uso de tabelas que relacionam PEEP com FiO2 (veja tabela 1). Porém, a diretriz reforça a recomendação contra o uso de estratégias de recrutamento alveolar prolongado (PEEP ≥ 35 cmH2O por um minuto ou mais).
- O uso de PEEP alta deve ser associado não apenas a uma reavaliação da oxigenação, mas também a um novo cálculo da mecânica pulmonar (pressão de platô, driving pressure ou até mesmo tomografia com impedância elétrica).
Corticoides
A diretriz faz uma recomendação fraca de utilizar corticoides em pacientes com SDRA, independente da gravidade. Desde a última diretriz de 2017, novas evidências mostram redução de mortalidade com o uso de corticoides em pacientes com e sem COVID-19 [11].
Mais recentemente, o estudo CAPE-COD também mostrou benefício de mortalidade com uso de hidrocortisona em pacientes com pneumonia grave (veja mais em Corticoides na Pneumonia Adquirida na Comunidade).
Ainda há incerteza na literatura sobre qual corticoide utilizar, dose e tempo de uso. Usos precoces no curso da doença (< 24 horas) e em pacientes mais graves parecem resultar em maior benefício [12].
ECMO veno-venosa

A diretriz emite uma nova recomendação para o uso de oxigenação por membranas extracorpórea (ECMO) em pacientes selecionados e que tenham falhado com as estratégias convencionais (ventilação protetora, prona, PEEP alta, etc.). Pacientes que mantêm relação P/F < 80 ou com hipercapnia significativa (pH < 7,25 e pCO2 ≥ 60) devem ser considerados para ECMO principalmente nos primeiros sete dias de doença. Por ser uma terapia pouco disponível e de alto custo, o uso deve ser preferencial para pacientes com menor risco de futilidade (veja tabela 2).
Recomendação contra - Manobras de recrutamento prolongado
A diretriz emite uma nova recomendação forte contra o uso de manobras de recrutamento prolongado, quando se usa PEEP alta (≥35 cmH2O) por um minuto ou mais.
O principal estudo sobre o assunto foi o ART, que randomizou pacientes com SARA moderada a grave para uma intervenção de recrutamento alveolar comparada a estratégia de PEEP baixa. O resultado do estudo foi um aumento de mortalidade em 28 dias no grupo intervenção [13]. Em 2022, uma meta-análise encontrou o mesmo achado [10].