Diretriz de Dissecção de Artérias Cervicais 2024 AHA/ASA
A dissecção de artérias cervicais pode representar até 25% de todos os acidentes vasculares cerebrais (AVC) em pacientes com menos de 50 anos de idade. A condição pode acometer tanto a circulação anterior, pela artéria carótida interna (ACI), como a circulação posterior, pelas artérias vertebrais. Esse tópico revisa a nova diretriz publicada na Stroke em fevereiro de 2024 [1].
AVC isquêmico em jovem: como abordar?
Pessoas com menos de 50 anos raramente são acometidas por AVC, com incidência aproximada de 8 a cada 100.000 habitantes em países de alta renda. A avaliação e condutas iniciais não mudam nessa população. No entanto, a investigação da causa do AVC tem particularidades que modificam a profilaxia secundária recomendada.
Nos jovens, há uma ocorrência menor das causas tradicionais de AVC - aterosclerose de grandes vasos, doença de pequenos vasos ou embolia cardíaca. Cerca de 50% dos AVC em pacientes com idade média de 70 anos são por causas tradicionais, já naqueles com menos de 50 anos essas causas explicam apenas 30% dos eventos [2, 3]. Isso significa que mais pacientes jovens têm o mecanismo do AVC "indeterminado" ou como "outras causas" - conforme o sistema de classificação TOAST.
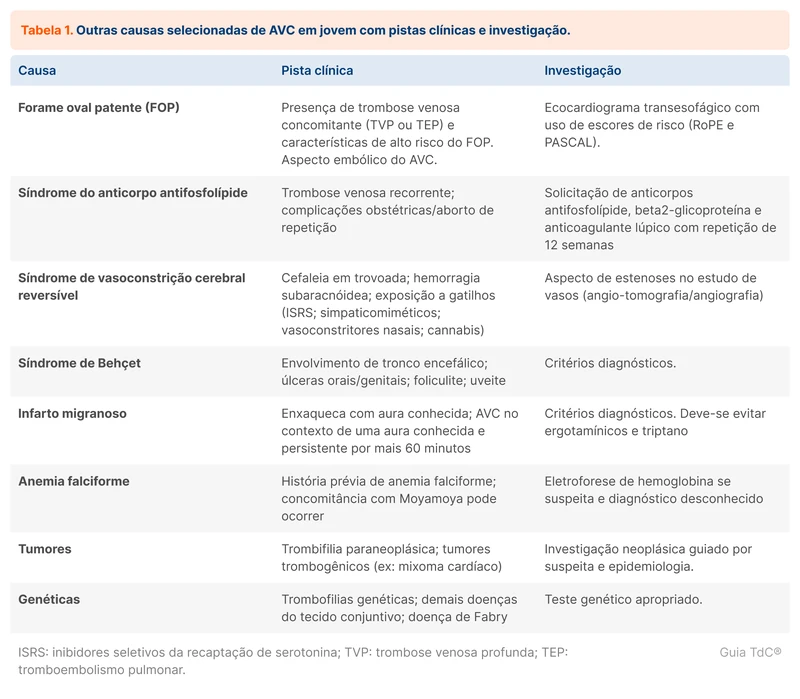
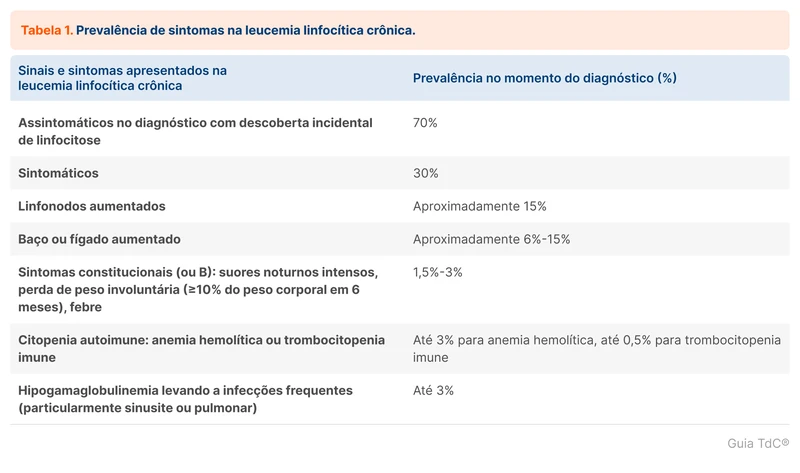
Analisando as causas individuais, a dissecção de artérias cervicais é a principal causa identificada na população jovem, representando até 25% dos casos de AVC em jovens. Outras causas são importantes e devem ser pesquisadas ativamente. Confira na tabela 1.
Como diagnosticar uma dissecção de artérias cervicais
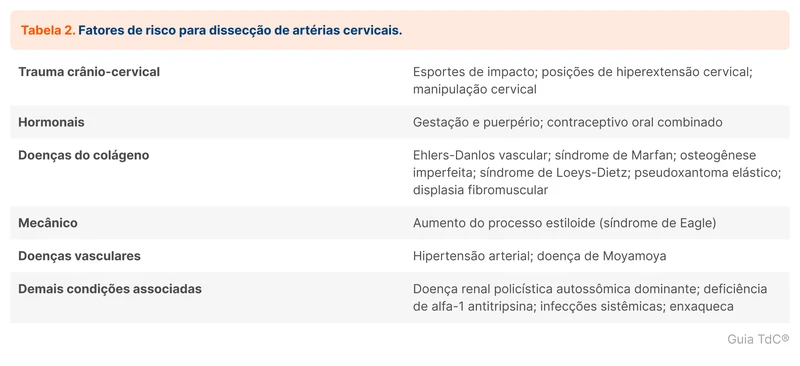
Diversas condições são fatores de risco ou predisponentes para dissecção de artérias cervicais, como expostos na tabela 2. A maioria das dissecções envolve algum trauma, seja intenso ou leve, como movimentar o pescoço para desviar de um objeto ou checar o banco de trás do carro. Perguntar ativamente sobre traumas craniocervicais, posições não usuais como hiperextensão ou flexão do pescoço ou manipulação cervical, pode ajudar na suspeita.
A maioria dos pacientes tem sintomas inespecíficos que precedem a ocorrência de AVC. Até 65% dos pacientes podem apresentar dor facial, cefaleia frontotemporal e síndrome de Horner (na dissecção carotídea) ou dor cervical e occipital (na dissecção vertebral) antes da ocorrência do AVC. No entanto, somente cerca de 3% dos pacientes procuram atendimento médico antes da ocorrência de isquemia cerebral.
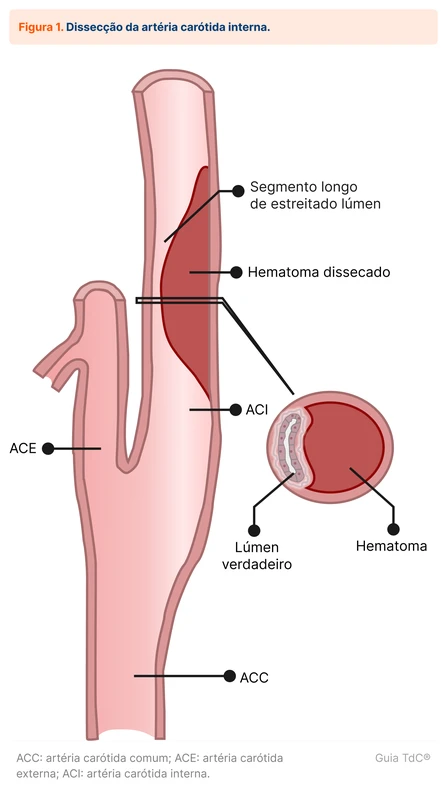
A artéria mais acometida por dissecções é a artéria carótida interna (ACI) na sua porção cervical. O principal mecanismo de AVC na dissecção é a embolia arterio-arterial. Isso ocorre por formação de trombos no falso lúmen, que são então embolizados e podem ocluir vasos após a dissecção (veja figura 1).
Apesar de haver suspeita pela história, a imagem é a principal ferramenta diagnóstica. O exame mais utilizado é a angiotomografia de artérias cervicais e intracranianas.
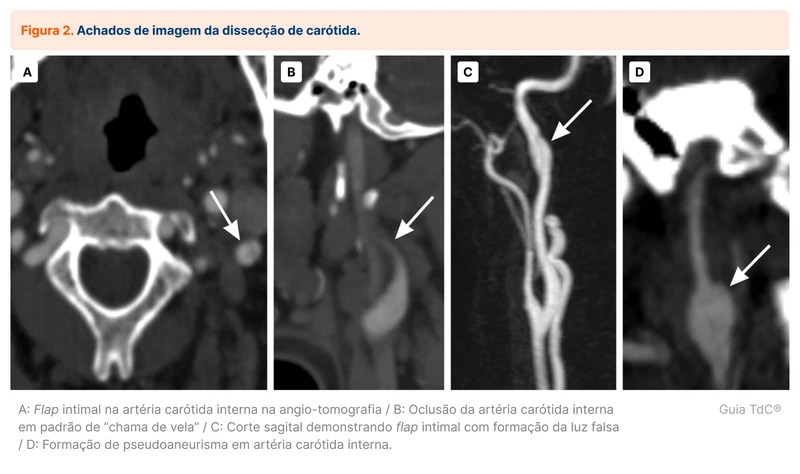
Os principais achados de imagem estão relacionados à formação de um falso lúmen da artéria acometida. É possível ver a formação de um flap intimal (deslocamento da camada íntima do vaso para o lúmen) e interrupção do vaso com um aspecto de “chama de vela”, pela oclusão progressiva do lúmen verdadeiro da artéria (veja figura 2 e figura 3). No corte axial, a separação da íntima é vista como um espessamento em formato de crescente.
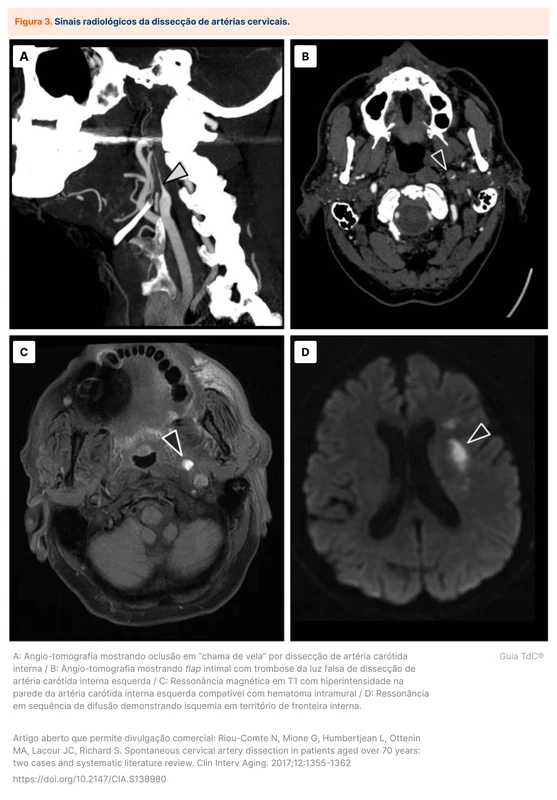
A oclusão cardioembólica de vasos calibrosos (carótida interna intracraniana, parte proximal da cerebral média e basilar) pode formar uma imagem de pseudo-oclusão da carótida interna extracraniana ou das vertebrais com aspecto em "chama de vela", similar ao de dissecções. Isso ocorre por obstrução ao fluxo de contraste. A interpretação desses casos deve ser cuidadosa, tentando diferenciar uma dissecção que levou a embolização arterio-arterial distal de um cardioembolismo que ocasionou imagem de chama de vela proximal à obstrução.
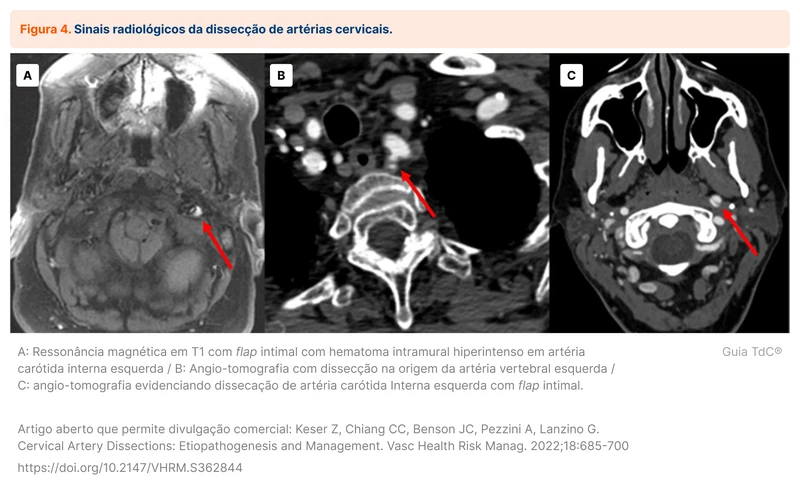
Há ferramentas adicionais na avaliação por ressonância magnética. Estudos de parede de vasos podem ser realizados, com o intuito de identificar trombos ou hemorragia na parede das artérias nas sequências ponderadas em T1 e estudos dedicados como o vessel wall (veja figura 4).
Como tratar uma dissecção de artérias cervicais e estabelecer profilaxia secundária
O tratamento agudo é o mesmo de outras causas de AVC isquêmico. O paciente deve receber os tratamentos de reperfusão agudas que for candidato. As indicações de trombólise pode ser vistas neste vídeo. As indicações de trombectomia foram comentadas no tópico AVC Isquêmico Maligno.
Como em todo AVC, deve-se estabelecer um plano de prevenção secundária de acordo com o mecanismo do evento. Na dissecção de artérias cervicais, o mecanismo envolvido em 85% dos casos é a embolia arterio-arterial, em que um trombo é formado no sítio de dissecção para então embolizar e ocluir um vaso mais distal. Existe dúvida de qual estratégia de profilaxia secundária é a mais benéfica: antiagregação ou anticoagulação?
Vários trabalhos foram desenhados para responder essa questão, dentre eles o CADISS, TREAT-CAD e o mais recente STOP-CAD, publicado em fevereiro de 2024. Uma sugestão de tratamento está exemplificada no fluxograma 1 [4-6]. Os estudos continham falhas metodológicas importantes, principalmente a heterogeneidade do grupo antiagregação no CADISS. Todos falharam em demonstrar não inferioridade de antiagregação em relação à anticoagulação, mas delimitou-se um pouco melhor que perfil de paciente se beneficia mais de cada estratégia.
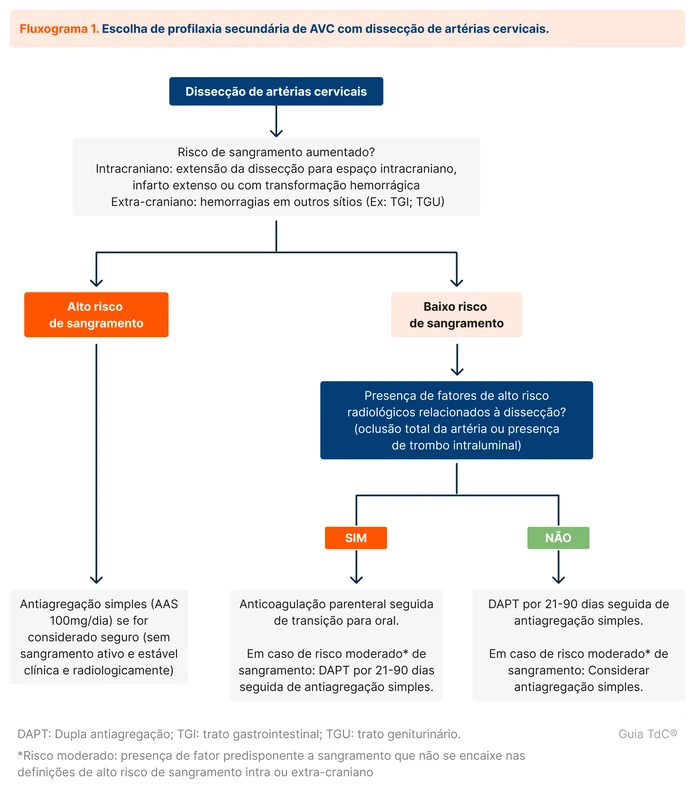
Cerca de 30% dos pacientes com oclusão completa no primeiro momento apresentaram recanalização com tempo médio de quatro meses. Após seis meses do diagnóstico, não há relação entre a doença arterial residual e risco de recorrência de AVC. Recorrência de dissecção é um evento raro, ocorrendo em 3,3% no seguimento de três anos.