Dengue: Dúvidas Comuns no Manejo
Segundo dados do Ministério da Saúde, até 19 de março de 2024, foram notificados mais de 1.937.000 casos de dengue no Brasil. Com o aumento do número de casos nas cidades, surgem dúvidas sobre o manejo de pacientes em situações especiais. Este tópico tem como objetivo responder dúvidas frequentes na condução de dengue.
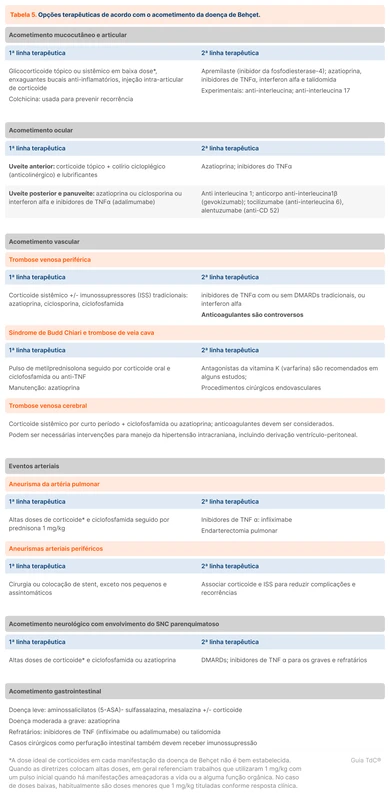
O que fazer com pacientes em uso de antiplaquetários?
O uso de antiagregantes plaquetários em pacientes com dengue, principalmente o ácido acetilsalicílico (AAS), e a dupla antiagregação plaquetária (DAPT) são um ponto controverso. O tempo em relação ao implante de stent pode ajudar na decisão. Dados retrospectivos sugerem que a interrupção temporária de antiplaquetários parece ser segura [1].
Implante de stent farmacológico há < 6 meses ou stent convencional até 1 mês
Nesses casos, o Ministério da Saúde (MS) orienta que pacientes em uso de DAPT devem manter a utilização durante a infecção.
Nos pacientes com contagem de plaquetas >50.000/mm³ não há necessidade de internação, mas recomenda-se a avaliação diária da plaquetometria.
Quando as plaquetas estão entre 30.000 e 50.000/mm³, os pacientes devem ser internados para observação, com controle diário da contagem de plaquetas, mas se a contagem plaquetária for abaixo de 30.000/mm³, deve-se suspender a dupla antiagregação plaquetária. O paciente deve ser mantido sob observação até que as plaquetas estejam acima de 50.000/mm³, quando a DAPT poderá ser reiniciada.
Em casos de sangramentos, está indicada transfusão de plaquetas, além das medidas específicas para interrupção da hemorragia.
Implante de stent farmacológico >6 meses ou stent convencional >1 mês
O MS orienta manter apenas o AAS desde que a contagem de plaquetas seja superior a 30.000/mm³.
Caso a contagem de plaquetas esteja entre 30.000 a 50.000/mm³, os pacientes deverão permanecer em observação com controle diário de plaquetas. Se a contagem plaquetária estiver abaixo de 30.000/mm³, o AAS deve ser retirado e só deverá ser reiniciado quando plaquetas superiores a 50.000/mm³.
Outras situações
Pacientes com profilaxia secundária de doença arterial coronariana ou cerebrovascular deverão utilizar apenas AAS, desde que o número de plaquetas seja superior a 30.000/mm³. As recomendações são semelhantes às do grupo anterior.
O que fazer com pacientes em uso de anticoagulante?
Nos pacientes em uso de varfarina, a conduta depende da contagem de plaquetas. Em pacientes com plaquetas >50.000/mm³, o INR deve ser vigiado e a contagem plaquetária deve ser monitorizada diariamente, sem necessidade de internação, unicamente, por esse fator. Quando a contagem plaquetária estiver <50.000 /mm³, o paciente deve ser internado. Se as plaquetas estiverem entre 30.000/mm³ e 50.000/mm³, a anticoagulação pode ser mantida, porém recomenda-se trocar a varfarina por heparina não fracionada. A heparina não fracionada é um anticoagulante com ação mais curta e mais fácil de ser revertida em caso de sangramento. A anticoagulação deve ser suspensa se a contagem plaquetária estiver abaixo de 30.000/mm³.
Em todos os cenários, a reversão da anticoagulação será realizada somente na presença de sangramento moderado ou grave.
Existem poucos estudos disponíveis sobre a contagem de plaquetas segura para manutenção ou suspensão de anticoagulação. Em um relato de caso realizado no Sri Lanka, a varfarina foi suspensa quando a contagem de plaquetas ficou abaixo de 100.000/mm³ e reiniciada quando acima de 50.000/mm³ [2].
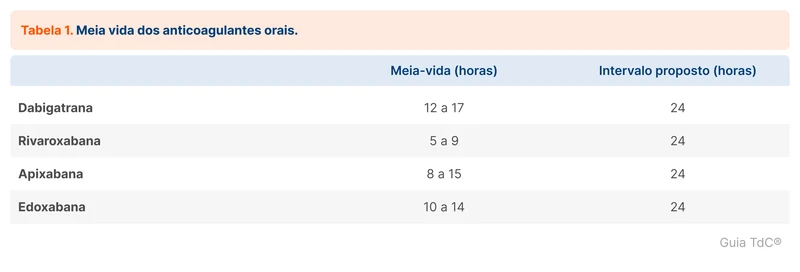
Também não há uma diretriz específica para manejo de anticoagulantes orais diretos (DOAC) na dengue. A decisão de manter o DOAC deve ser individualizada, considerando a gravidade da plaquetopenia e a indicação para anticoagulação. O MS orienta que em pacientes com plaquetas abaixo de 50.000/mm³, deve-se substituir o DOAC para heparina não fracionada endovenosa, após 24 horas da última administração do DOAC ou quando decorrido o período de 2 vezes a meia-vida dos medicamentos (veja tabela 1).
Quando internar por plaquetopenia?
A redução progressiva do número de plaquetas é um bom preditor da gravidade do paciente, quando acompanhada de aumento do hematócrito. No entanto, não há limite específico de contagem de plaquetas para indicar a hospitalização.
Em contrapartida, o MS recomenda contagem plaquetária >50.000/mm³ para alta hospitalar. Partindo dessa orientação, pode-se ponderar que valores de plaquetas abaixo de 50.000/mm³ provavelmente são indicativos de gravidade e consequente necessidade de internação. É necessário individualizar os valores de corte adequados para cada caso.
Quando transfundir plaquetas?
O MS recomenda considerar transfusão de plaquetas em pacientes com:
- sangramento persistente não controlado, após correção dos fatores de coagulação e do choque;
- plaquetopenia e INR >1,5 vezes o valor normal.
A diretriz de 2022 da OPAS (Organização Pan-Americana da Saúde) não recomenda transfusão de hemocomponentes na presença de plaquetopenia [3].
Um estudo não randomizado realizado em Singapura avaliou a transfusão profilática em pacientes com contagem de plaquetas <20.000 /mm³ na ausência de sangramento, exceto petéquias, quanto a redução de hemorragia com repercussão clínica, tempo de internação e mortalidade [4]. Não houve diferença significativa na presença de sangramento com repercussão clínica entre o grupo que não recebeu transfusão e o grupo que recebeu. O grupo intervenção apresentou um tempo de internação hospitalar maior (mediana de 1 dia) e não houve diferença de mortalidade entre os dois grupos. Dados semelhantes foram encontrados em um estudo singapurense anterior [5].
Outro estudo realizado em Singapura, comparou suporte transfusional e suporte clínico versus apenas suporte clínico em pacientes com plaquetas ≤20.000/mm³ sem sangramentos. O desfecho avaliado foi presença de sangramento até o dia 7 ou até alta hospitalar.
Concluiu-se que a transfusão profilática de plaquetas não foi superior ao suporte clínico na prevenção de hemorragias e pode apresentar eventos adversos [6]. Esse dado é corroborado por um estudo randomizado no qual a transfusão de plaquetas não impediu o desenvolvimento de hemorragia grave nem reduziu o tempo para a cessação da hemorragia [7].
Um estudo indiano, com 1349 pessoas, demonstrou que 20% dos pacientes da amostra apresentaram manifestações hemorrágicas de gravidade variável. Os pacientes que apresentavam uma contagem de plaquetas inferior a 10.000/mm³ tiveram hemorragia significativa com risco à vida, sendo este valor de corte adotado para indicar transfusão de plaquetas [8].
Cristaloide ou coloide: qual é a solução de escolha?
Um estudo comparou o uso de ringer lactato contra dois coloides em crianças com dengue grave. A resposta a ressuscitação volêmica inicial com ringer lactato foi semelhante em relação aos dois coloides com efeitos adversos semelhantes [9]. Outro estudo não encontrou benefício quando comparou dois coloides contra NaCl 0,9% e ringer lactato em crianças com dengue [10].
Segundo a OPAS, comparando cristaloides e coloides, as evidências sugerem não existir diferença na mortalidade (não foram observados eventos em nenhum dos grupos nos quatro estudos incluídos), no risco de choque recorrente ou resistente ao tratamento (RR = 1,06; IC 95% 0,82-1,37) ou na sobrecarga de volume (RR = 1,01; IC 95%: 0,76-1,34). O uso de cristaloides reduz o risco de eventos adversos ou alérgicos relacionados à infusão quando comparados a coloides.
Outro ponto positivo é o custo dos cristaloides ser inferior ao custo dos coloides. Considerando os dados, a OPAS recomenda a utilização de cristaloides no tratamento inicial de pacientes com dengue grave.
O MS orienta que em pacientes com dengue grupo D com hematócrito em ascensão, mesmo após a reposição volêmica adequada com cristaloides, pode-se utilizar expansores plasmáticos como a albumina 0,5 a 1 g/kg.