Bicarbonato na Doença Renal Crônica
Foi publicada em abril de 2024 a diretriz de doença renal crônica do Kidney Disease Improving Global Outcomes (KDIGO) [1]. Não houve recomendação de reposição de bicarbonato de sódio para acidose metabólica por ausência de ensaios clínicos grandes que embasam o uso. Essa mudança revisita a pergunta: será que tem evidência para uso do bicarbonato na doença renal crônica? Este tópico revisa o assunto.
Como evitar a progressão da doença renal crônica?
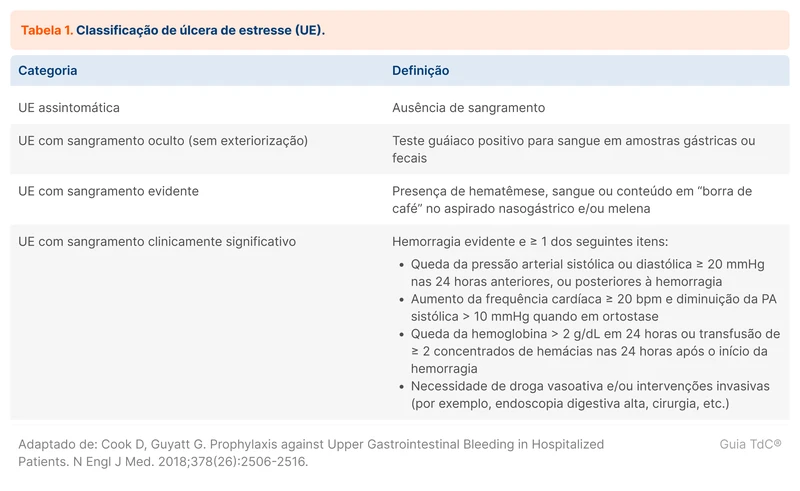
A estratégia para reduzir a progressão da doença renal crônica (DRC) envolve o controle de comorbidades como hipertensão, diabetes e obesidade, e medicamentos para tratar a nefropatia. O estadiamento da doença renal crônica é utilizado como guia para as recomendações a seguir (tabela 1) [1].
Os principais medicamentos que comprovadamente retardam a progressão da DRC são:
- iECA ou BRA
- iSGLT2
- Finerenona
Um IECA ou BRA é recomendado na maior dose tolerada para pacientes com DRC diabética com albuminúria > 30 mg/g (A2) e DRC não diabética com albuminúria > 300 mg/g (A3). Também são recomendados para todos os pacientes com DRC e albuminúria > 30 mg/g (A2), em menor grau de evidência de benefício.
Os iSGLT2 são recomendados para todos os pacientes com diabetes e DRC com taxa de filtração glomerular estimada (TFGe) ≥ 20 mL/min/1.73 m². Já para pacientes sem diabetes e com DRC com TFG ≥ 20 mL/min/1.73 m², são recomendados se albuminúria ≥ 200 mg/g ou na presença de insuficiência cardíaca, independente da albuminúria. Com menor grau de evidência, há sugestão do uso para todos os pacientes com TFGe de 20 a 45 mL/min/1.73 m², mesmo sem albuminúria.
A finerenona é sugerida para pacientes com DRC que mantêm albuminúria > 30 mg/g apesar do uso de iECA ou BRA, com TFGe > 25 mL/min/1.73 m² e potássio normal. Mais detalhes no tópico sobre finerenona na nefropatia diabética.
Evidências do uso do bicarbonato de sódio
Em 2021, uma revisão sistemática identificou 15 estudos sobre os efeitos da reposição do bicarbonato em pacientes com DRC [2]. Foi observada lentificação da redução da TFGe com o bicarbonato. A certeza dos achados e a qualidade da evidência foram consideradas baixas. Considerando apenas os estudos controlados com placebo, o benefício não foi encontrado. Dentre os estudos avaliados, dois merecem destaque: UBI e Bicarb.
O UBI foi o maior estudo e avaliou o uso de bicarbonato de sódio para tratamento da acidose metabólica. Foi um ensaio clínico randomizado e aberto com 700 pacientes, porém sem controle com placebo. Houve redução de mortalidade, menor risco de evolução para diálise e menor risco de piora da função renal com o uso do bicarbonato em pacientes com TFGe < 60 ml/min, acidose metabólica e bicarbonato sérico inicial entre 18 e 24 mmol/L. A meta de correção era manutenção do bicarbonato entre 24 e 28 mmol/L [ 3].
O estudo BiCARB foi um ensaio clínico randomizado, cegado e controlado por placebo com análise por intenção de tratar. Esse trabalho avaliou o uso de bicarbonato de sódio na população com mais de 60 anos e TFGe < 60 ml/min, sendo o desfecho primário um instrumento de avaliação do desempenho físico (Short Physical Performance Battery - SPPB). Foram 150 participantes com uma média de idade de 74 anos. Não houve diferença no desfecho primário. Também não houve diferenças em desfechos secundários que incluíram desfechos renais, como piora da TFGe e progressão para diálise, mortalidade e desfechos de qualidade de vida e funcionalidade. Mais eventos adversos foram encontrados no grupo intervenção.
O BiCARB é alvo de algumas críticas. Houve problemas no recrutamento, que foi lento e durou quatro anos. A intervenção atingiu até 3 g/dia de bicarbonato nos pacientes que não atingiram a meta de bicarbonato sérico após três meses com a dose inicial de 1,5 g/dia. Essa dosagem é considerada relativamente baixa, já que o estudo BASE observou que doses maiores (aproximadamente 5 g/dia) foram mais efetivas no controle da acidose do que doses de 3 g [4]. Esses fatores podem ter levado ao resultado negativo do trabalho. Por outro lado, o BiCARB pode ter representado situações mais próximas à realidade, em que doses relativamente baixas são usadas por conta de efeitos colaterais.
Mudanças de 2012 a 2024 no KDIGO
Em 2012, a diretriz de DRC do KDIGO recomendou o tratamento com bicarbonato para pacientes com DRC e acidose metabólica, por considerar um tratamento de baixo custo e com potencial de benefício como adjuvante.
Já na diretriz de 2024, não há mais recomendação do uso de bicarbonato para pacientes ambulatoriais com DRC. O grupo mudou a recomendação por ausência de ensaios clínicos grandes positivos que embasem seu uso. Apesar disso, os autores sugerem que deve ser considerada em pacientes com acidose grave, com potencial complicação clínica (por exemplo, bicarbonato menor do que 18 mmol/L).
Como repor bicarbonato?
A dose inicial é de 0,5 a 1 mEq/kg de bicarbonato por dia, dividido em três tomadas. Um grama de bicarbonato de sódio fornece 12 mEq de bicarbonato, ou seja, deve ser indicado entre 3 a 6 gramas de bicarbonato de sódio para um adulto de 70 quilos. Em situações de poucos recursos, o bicarbonato de sódio de cozinha pode ser utilizado, apesar da evidência se basear em relatos de casos [5, 6]. Meia colher de chá contém 2 gramas de bicarbonato. Assim, uma prescrição possível seria meia colher de chá de bicarbonato de sódio 3 vezes ao dia.
O principal efeito colateral do bicarbonato de sódio é a intolerância gastrointestinal. O citrato de sódio é uma opção nesse caso, por ser melhor tolerado [7]. Outras opções são o acetato de cálcio e o carbonato de cálcio. O veverimer, um ligante do ácido clorídrico que remove ácidos do trato gastrointestinal, está em estudo e ainda não está disponível para uso [8]. Uma dieta rica em frutas e vegetais reduz a acidose metabólica e também é uma forma de tratamento do quadro [9].