Imitadores de Sepse
Sepse é uma das principais causas de óbito no mundo e está frequentemente envolvida em erros diagnósticos. Um trabalho recente avaliou quais os diagnósticos finais de pacientes conduzidos inicialmente como sepse na UTI [1]. Neste tópico são revistos os critérios de sepse e a conduta recomendada em casos de incerteza diagnóstica.
Qual a definição de sepse?
Não existe um padrão-ouro para o diagnóstico de sepse. A última atualização mundial da definição de sepse foi realizada em 2016 por uma força tarefa conhecida como Sepsis 3. A força tarefa definiu sepse como a presença de disfunção orgânica ameaçadora à vida secundária à resposta desregulada do organismo à infecção [2].
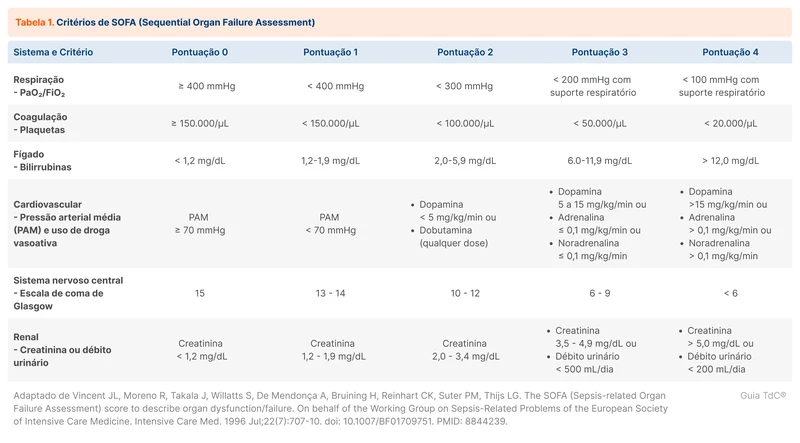
A ferramenta sugerida para a avaliação de disfunção orgânica é o Sequential Organ Failure Assessment (SOFA). Veja na Tabela 1. A presença de dois ou mais pontos caracteriza disfunção orgânica significativa. Quando existe disfunção orgânica crônica prévia a infecção, deve-se considerar apenas a variação de pontos em relação ao escore SOFA basal do paciente. Como exemplo, um paciente com creatinina prévia de 1,5 mg/dL já teria um escore SOFA de um ponto. Caso procurasse a emergência e fosse identificada creatinina de 2,5 mg/dL, apesar de seu escore SOFA de dois pontos, a variação seria de apenas um ponto. Em pacientes sem histórico conhecido, a orientação é assumir que não possuíam disfunção orgânica prévia.
Os erros diagnósticos associados a sepse podem ocorrer de duas maneiras:
- pacientes com sepse, sem o diagnóstico de sepse
- pacientes sem sepse, diagnosticados como sepse.
A falha em reconhecer sepse ocorre principalmente na ausência de sintomas típicos de infecção, como: hipotermia ou hipertermia, calafrio, hipotensão, tosse com secreção, disúria ou eritema cutâneo. Um estudo encontrou que 30% dos pacientes com diagnóstico final de sepse não apresentavam sinais explícitos de infecção na admissão no pronto-socorro. A mortalidade foi maior nesse grupo de pacientes, assim como os tempos para iniciar antibióticos, fazer o diagnóstico de sepse e internar na UTI também foram maiores [3].
Quais são os imitadores de sepse?
Algumas doenças não infecciosas podem causar disfunções orgânicas agudas, podendo ser confundidas com infecções. Os exemplos mais frequentes são pacientes com insuficiência cardíaca congestiva ou síndrome do desconforto respiratório agudo não desencadeados por processos infecciosos. Menos de 60% dos pacientes com admissão em UTI por sepse confirmam um quadro infeccioso [4].
Algumas doenças menos comuns podem se apresentar com quadro clínico bastante semelhante à sepse, sendo reconhecidas como imitadoras de sepse. Um exemplo é a síndrome de liberação de citocinas (SLC). Essa condição é definida como uma elevação de citocinas resultando em inflamação exagerada e disfunção orgânica. A definição é ampla e se sobrepõe com sepse, mas o termo SLC é classicamente reservado para outros processos inflamatórios diferentes de sepse, como reação a terapias específicas (células CAR-T, inibidores de checkpoint e transplante de células hematopoiéticas) e infecção por COVID-19 [5]. Veja mais sobre no tópico Terapia com Células CAR-T.

Outra situação caracterizada por um processo inflamatório exagerado causando disfunção orgânica é a síndrome hemofagocítica ou linfohistiocitose hemofagocítica. Essa síndrome também se sobrepõe a sepse e a SLC, porém possui critérios diagnósticos bem estabelecidos (tabela 2). Pode ser primária, associada a mutações genéticas, ou secundária, desencadeada por outras condições. Os principais desencadeadores de SHF secundária são neoplasias, doenças autoimunes e as infecções. Um dos recursos que ajuda a diferenciar SHF de sepse é o valor de ferritina. Um trabalho sugere o valor de ferritina de 9083 µg/l como a melhor maneira de diferenciar as duas condições, já que valores superiores estão mais relacionados com SHF [6, 7]. Veja uma discussão envolvendo síndrome hemofagocítica no neste caso clínico discutido no Guia.
O que fazer na incerteza de sepse
A espera de exames confirmando uma infecção pode atrasar o início de antibioticoterapia em casos de sepse. O prejuízo pode ser significativo, já que o início precoce de antibioticoterapia é a intervenção com maior benefício [8]. Por outro lado, considerar todos os pacientes com possível foco infeccioso como sépticos pode resultar em uso irracional de antibióticos.
A atualização de sepse de 2021 sugere uma solução para esse impasse. O documento indica que o paciente pode ser classificado como tendo sepse possível ou sepse provável. A distinção entre possível e provável considera a impressão do médico assistente, não havendo um escore para essa estimativa [9].

Todo paciente com sepse provável deve receber antibioticoterapia em até uma hora. Se posteriormente for feito um diagnóstico não infeccioso, o antibiótico deve ser retirado. Pacientes com sepse possível são subdivididos conforme a presença de choque. Se houver choque, mesmo a sepse sendo apenas possível, o antibiótico deve ser infundido em até uma hora. Se não houver choque, é possível esperar até três horas para o resultado de outros exames que confirmem o diagnóstico de sepse ou infecção (tabela 3)
O que o trabalho mostrou?
Um trabalho retrospectivo, realizado na Suécia, selecionou 2664 pacientes que apresentavam uma disfunção orgânica associada à coleta de culturas na chegada da UTI e início de antibioticoterapia empírica [1]. Esses pacientes eram inicialmente categorizados como sepse presumida. Conforme evolução clínica na internação, estes pacientes foram divididos em dois diagnósticos: sepse confirmada e imitador da sepse. Foram classificados como sepse confirmada aqueles com cultura positiva ou quando a infecção foi considerada provável por um escore clínico. Pacientes sem esses critérios eram incluídos no grupo de imitadores de sepse.
Entre todos os pacientes, 2008 (75%) confirmaram sepse (1542 com cultura positiva e 466 com infecção provável) e 656 (25%) foram classificados como tendo um imitador. Os grupos tiveram mortalidade similar. Uma das principais diferenças entre os dois grupos foi a suspeita de infecção pelo médico assistente, ocorrendo em 70% no grupo de imitadores e 87% no grupo de sepse confirmada. Em outro trabalho com essa temática, a impressão do médico foi superior a escores de rastreio para identificar sepse em um cenário de emergência [10].
Pacientes com sepse confirmada precisaram de mais droga vasoativa, porém o nível de lactato foi similar nos dois grupos. Marcadores laboratoriais como proteína C reativa e procalcitonina eram menores nos pacientes com imitadores de sepse. Pacientes com sepse tiveram mediana de proteína C reativa de 215 mg/L e sem sepse de 92 mg/L. Já a mediana da procalcitonina do grupo sepse foi de 7,3 mcg/L e no grupo sem sepse de 1,1 mcg/L. Os principais imitadores de sepse foram insuficiência respiratória inespecífica, insuficiência cardíaca aguda e parada cardíaca.