Tratamento de Bacteremia por Gram-Negativos
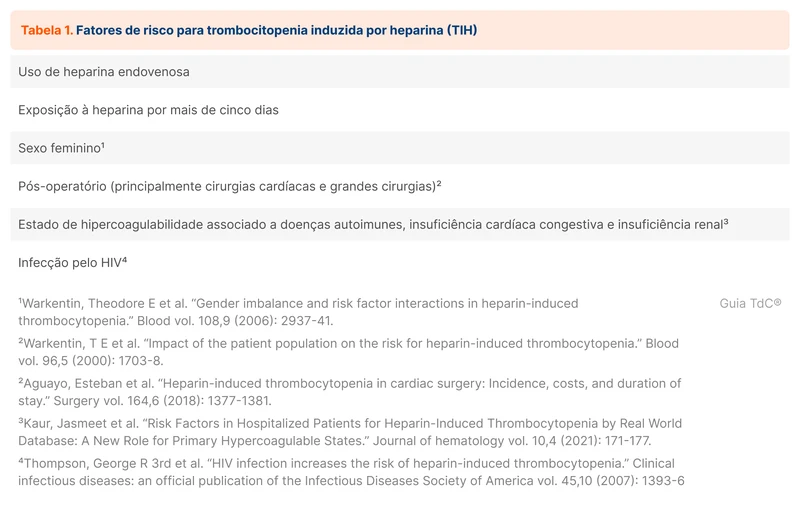
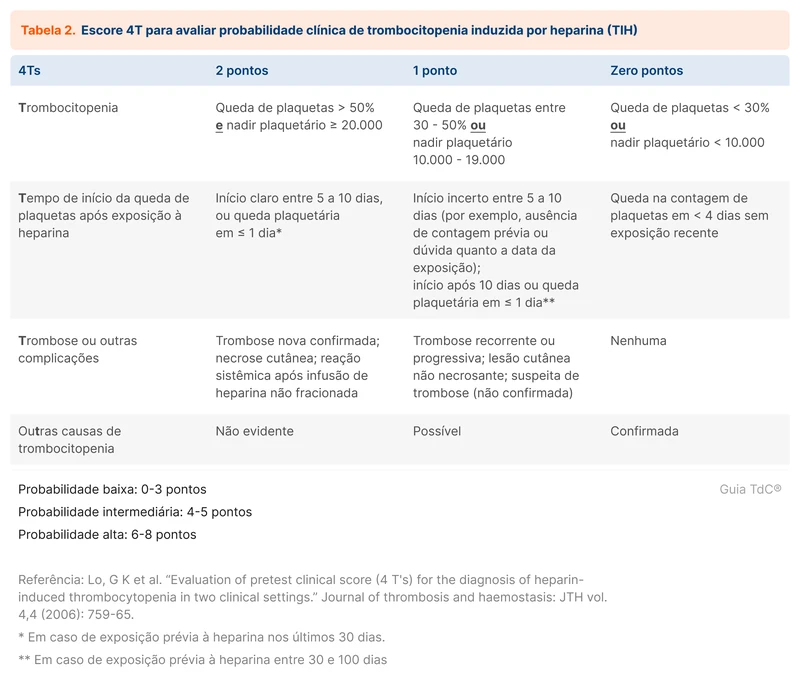
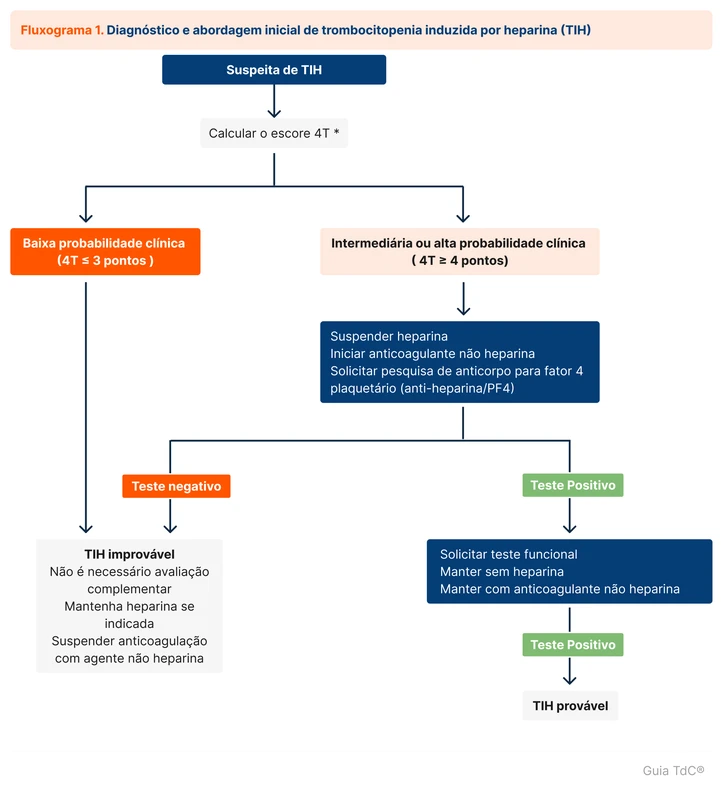
Houve um aumento global da incidência de bacteremia por gram-negativos nos últimos anos, associada com maior mortalidade e morbidade. Em 2023 foi publicada uma revisão sistemática e meta-análise comparando 7 e 14 dias de tratamento antimicrobiano nessa condição [1]. Esse tópico revisa o tratamento de bacteremia por gram-negativos.
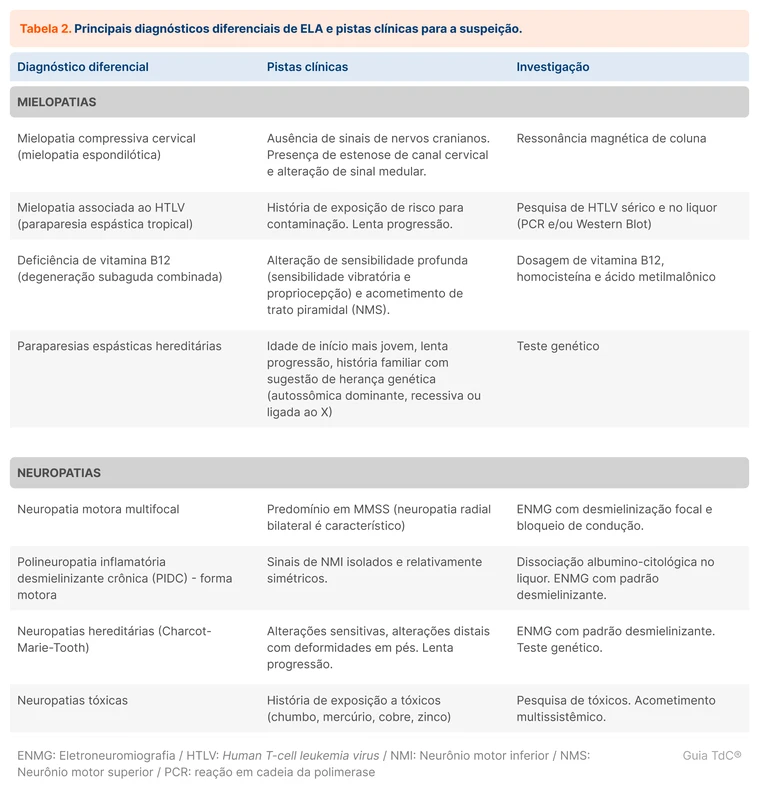
Tipos de bacteremia por gram-negativos
Bacteremia por bactérias gram-negativas é o crescimento de bactérias gram-negativas em hemocultura. Outro termo usado como sinônimo de bacteremia é infecção de corrente sanguínea (ICS). A ICS pode ser primária ou secundária:
- ICS primária: crescimento de bactérias em hemocultura sem foco infeccioso definido ou por infecção associada a cateter.
- ICS secundária: crescimento de bactérias em hemocultura em consequência a infecção em outros sítios. Exemplo: infecção do trato urinário (ITU) ou pneumonia com hemocultura positiva.
Apesar dessa definição, é comum o termo ICS ser usado como sinônimo de infecção associada a cateter. Porém, ICS primária sem associação com cateter pode ocorrer, especialmente em pacientes com neoplasias hematológicas, particularmente quando são submetidos a quimioterapia e evoluem com neutropenia.
Do ponto de vista clínico, o termo bacteremia também é usado informalmente para descrever episódios de tremores, calafrios e febre. Esses sinais não são totalmente específicos de ICS, sendo necessário verificar a presença de bacteremia com hemocultura se houver suspeita clínica.
As principais bactérias gram-negativas associadas a bacteremia são o grupo das Enterobacterales que inclui a Escherichia coli, Klebsiella spp, Proteus spp e Enterobacter spp. As infecções comunitárias mais comumente associadas a bacteremia são ITU, infecções intra-abdominais e pneumonia. No contexto hospitalar, infecção associada a dispositivos e pneumonia associada a ventilação são as principais fontes [2].
Outro grupo importante entre as infecções hospitalares são os bacilos gram-negativos não fermentadores, como Pseudomonas spp, Acinetobacter spp e Stenotrophomonas spp.
Antibióticos para tratamento de bacteremia por gram-negativos
Os antibióticos usados para tratamento de bacteremia por gram-negativos estão nesse arquivo. Os beta-lactâmicos são comumente o tratamento de escolha, devido à segurança e ampla evidência de eficácia. Fluoroquinolonas e sulfametoxazol/trimetoprima são utilizados como opções orais. Aminoglicosídeos e polimixina B são usados principalmente em infecções resistentes.
Em infecções frequentemente causadas por gram-negativos, como ITU e infecção intra-abdominal, o esquema de tratamento empírico já deve conter antibióticos para tratamento dessas bactérias. Se o agente etiológico for encontrado, o antibiótico empírico inicial pode ser mantido, se for adequado. Não há necessidade de modificação de antibiótico por conta da ocorrência de bacteremia, contanto que a bactéria isolada seja sensível à terapia escolhida. A cobertura para outros microorganismos pode ser suspensa após identificação do agente, caso não haja mais suspeita de infecção por outras bactérias.
Após a identificação de bacteremia, existem três momentos possíveis de ajuste de tratamento: identificação pelo gram, identificação da bactéria e o antibiograma. Os três resultados ficam disponíveis em momentos diferentes.
- Identificação pelo gram: dentre os gram-negativos, os bacilos são as principais bactérias identificadas. Outras bactérias podem ser identificadas no gram, como coco-bacilos, a exemplo do Haemophilus influenzae na pneumonia, e cocos gram-negativos, como Neisseria meningitidis na meningite. Esses casos podem necessitar de ajuste medicamentoso. No momento em que se identifica uma bactéria gram negativa, a suspensão de cobertura de outros grupos bacterianos deve ser considerada. Por exemplo: suspensão de vancomicina, utilizada empiricamente para cobertura de gram-positivos.
- Identificação da bactéria: alguns bacilos gram-negativos estão diretamente associados a resistência e têm tratamento específico. O destaque são os gram-negativos não fermentadores como Pseudomonas aeruginosa, Acinetobacter baumannii e Stenotrophomonas sp.
- Antibiograma: nesse momento são identificados os padrões de resistência. Os bacilos gram-negativos estão associados a produção de beta-lactamases. As cefalosporinases (exemplos: ESBL e AMPc) são beta-lactamases que conferem resistência a cefalosporinas. Bactérias com cefalosporinases são tratadas com cefepima, piperacilina/tazobactam ou carbapenêmicos a depender da situação. As carbapenemases (exemplos: KPC e NDM), betalactamases que propiciam resistência a carbapenêmicos, são tratadas com cefalosporinas associadas a novos inibidores de betalactamases ou com combinações de antimicrobianos.
Veja mais sobre o tratamento de enterobactérias produtoras de AmpC, Acinetobacter baumannii produtor de carbapenemase e Stenotrophomonas maltophilia no tópico Tratamento de Bactérias AmpC, CRAB e Stenotrophomonas maltophilia.
Tempo de tratamento de bacteremia por gram-negativos
O tempo de tratamento de infecções bacterianas está sendo revisado nos últimos anos. Estudos comparando tempos mais curtos de antibioticoterapia para várias infecções (pneumonia, ITU, infecção intra-abdominal, infecção de pele e outras) sugerem desfechos similares a tratamentos longos [3].
Em 2023, uma revisão sistemática e meta-análise avaliou três estudos randomizados incluindo 1186 pacientes, sendo 1121 com bacteremia por Enterobacterales [1]. Não foi encontrada diferença de mortalidade em 30 e 90 dias quando comparados tratamentos de 7 ou 14 dias. Recidiva, tempo de internação, readmissões e complicações infecciosas também foram similares entre os grupos. Alguns grupos foram excluídos, como imunossuprimidos graves (neutropenia com leucócitos < 500 células/microL, por exemplo) e pacientes com endocardite, fasciíte necrosante e osteomielite. Infecções por Pseudomonas, Acinetobacter e outros bacilos gram-negativos não fermentadores foram pouco representadas na amostra.
A transição para tratamento por via oral também vem sendo discutida no tratamento de outras infecções bacterianas, incluindo endocardite e osteomielite [4]. Para bacteremia por gram-negativos, estudos retrospectivos sugerem desfechos similares (falha de tratamento e mortalidade, principalmente) com a transição para antibioticoterapia via oral nos primeiros cinco dias [5, 6, 7].
Um estudo aberto, randomizado, publicado no Clinical Microbiology and Infection em outubro de 2023, comparou antibiótico endovenoso durante todo tratamento contra modificar para tratamento oral após três a cinco dias [5]. O desfecho primário foi um composto de morte por qualquer causa, necessidade de tratamento antimicrobiano adicional, recidiva microbiológica e readmissão associada a infecção. Não houve diferença significativa entre os dois grupos, atingindo o critério de não inferioridade do trabalho. O estudo foi feito com apenas 165 pacientes, apesar da programação inicial de incluir 438, diminuindo o poder estatístico da amostra. Um estudo randomizado com tamanho programado de 720 pacientes está em curso [8].