Hipoglicemia na Diabetes: Diretriz de Manejo Ambulatorial
A hipoglicemia é um dos principais efeitos adversos no tratamento medicamentoso da diabetes. Em fevereiro de 2024, o Journal of the American Medical Association publicou uma sinopse da diretriz de 2023 da Endocrine Society sobre o manejo de pacientes com diabetes e alto risco de hipoglicemia [1, 2]. Este tópico aborda as principais recomendações desses documentos.
Como avaliar o risco de hipoglicemia no paciente ambulatorial
A hipoglicemia é um evento comum em pacientes com diabetes. Impacta na qualidade de vida, dificulta a aderência e aumenta custos em saúde e número de visitas ao pronto-atendimento. É mais comum em pessoas com menor renda e escolaridade e naqueles com insegurança alimentar.
Um classificação dos eventos hipoglicêmicos foi proposta pela American Diabetes Association. Inicialmente foi desenvolvida para indivíduos com diabetes tipo 1 (DM 1), mas é comumente usada na prática para outros grupos de pacientes. Os eventos são classificados segundo a concentração sérica e manifestações clínicas [3]:
- Nível 1 - Glicose < 70 mg/dL e ≥ 54 mg/dL. Esse nível de hipoglicemia pode ser assintomático, mas deve alertar o paciente para prevenir progressão da queda dos níveis de glicose;
- Nível 2 - Glicose < 54 mg/dL. Associado ao aumento do risco de sintomas neuroglicopênicos (alteração comportamental, visual e rebaixamento do nível de consciência) e mortalidade;
- Nível 3 - Alteração do estado mental ou físico em consequência da hipoglicemia que necessite da assistência de terceiros, independente dos níveis de glicose.
Pessoas com DM 1 são consideradas de alto risco para hipoglicemia e podem apresentar episódios sintomáticos até duas vezes na semana. No diabetes tipo 2 (DM 2), o risco é aumentado nas seguintes situações:
- Uso de insulina ou secretagogos (como sulfonilureias)
- Disfunção renal e/ou hepática
- Longo tempo de doença
- Idosos
- Déficits cognitivos ou intelectuais
- Episódios pouco sintomáticos de hipoglicemia
- Uso de álcool e medicamentos predisponentes (ver caso clínico 17)
Orientando o tratamento de hipoglicemia ambulatorial
Todo paciente sob risco de hipoglicemia deve ser orientado a manejar um episódio de hipoglicemia ambulatorialmente. As condutas podem ser divididas pelo nível do evento:
- Hipoglicemia nível 1: serve de alerta para tendência à queda e necessidade de ingesta de carboidratos para prevenir a piora da hipoglicemia. É recomendado evitar tarefas críticas, como dirigir. Deve-se revisar a aplicação de insulina ou medicamentos, além de medir a glicemia na próxima hora.
- Hipoglicemia nível 2: o paciente deve corrigir a hipoglicemia com a ingesta oral de carboidratos. A orientação é administrar 15 gramas de carboidratos simples (como uma colher de sopa de açúcar, três sachês de mel ou 150 ml de refrigerante comum). Após 15 minutos a glicemia deve ser aferida e, caso persista a hipoglicemia, as medidas podem ser repetidas.
- Hipoglicemia nível 3: ameaçador à vida e requer tratamento emergencial. O auxílio de um terceiro é necessário para administrar carboidratos ou glucagon. A administração oral de carboidratos não deve ser realizada em pacientes com diminuição do nível de consciência, pelo risco de broncoaspiração. No extra-hospitalar não há possibilidade de acesso venoso. Nesse cenário, o glucagon (disponível pelas vias nasal, intramuscular ou subcutânea) é a melhor opção até a obtenção de uma via endovenosa para administração de glicose. A diretriz traz a preferência do uso de preparações de glucagon que não necessitem de reconstituição (como as apresentações farmacológicas em pó), facilitando sua aplicação no ambiente ambulatorial [2]
Dispositivos de monitorização de glicose ambulatoriais
O tratamento ambulatorial do DM evoluiu com o desenvolvimento de dispositivos voltados para a monitorização dos níveis de glicose. Os três dispositivos mais relevantes são: (1) monitores de glicose contínuos em tempo real; (2) monitores de glicose contínuos de aferição intermitente; e (3) glicosímetros manuais. Ver figura 1 e figura 2.
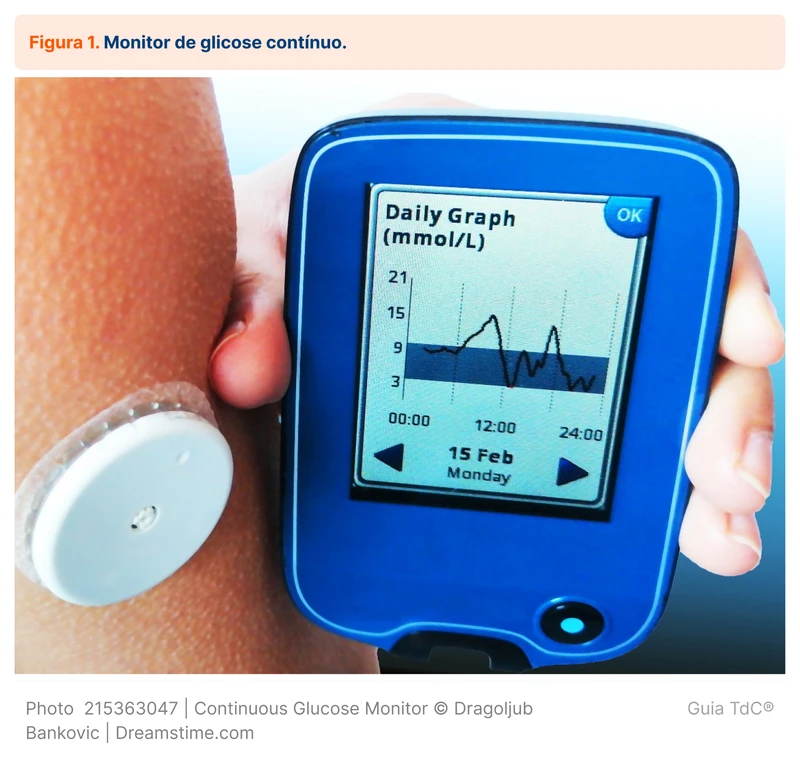
Os monitores de glicose contínuos em tempo real são os dispositivos mais recentes, aferindo a glicose intersticial a cada um a cinco minutos. As informações são enviadas automaticamente para um dispositivo (receptor, bomba de insulina ou smartphone), provendo dados sobre os níveis de glicose em tempo real para o usuário.
Monitores de glicose contínuos de aferição intermitente funcionam de maneira semelhante aos de tempo real, porém dependem que o usuário faça ativamente a leitura manual do sensor com um dispositivo. Gerações mais recentes fornecem um alerta de predição de hipoglicemia.
Os glicosímetros manuais são os tradicionais e amplamente disponíveis aparelhos de leitura de glicemia capilar, onde o paciente realiza o automonitoramento dos níveis de glicose. A frequência e o horário das aferições são orientadas conforme o tipo de tratamento, intensidade do controle glicêmico desejado e risco de desenvolvimento de hipoglicemia.
Recomendações para diminuir o risco de hipoglicemia
Os monitores de glicose contínuos em tempo real são preferíveis em comparação ao automonitoramento dos níveis de glicose. Esta recomendação é tanto para pacientes com DM 1 (recomendação forte, baixa qualidade de evidência), como para pacientes com DM 2 utilizando terapia com insulina ou sulfonilureias e alto risco de hipoglicemia (recomendação condicional, baixa qualidade de evidência).
Quando comparada com o automonitoramento, a monitorização contínua esteve associada à menor incidência de hipoglicemia [4]. Também esteve associada a menor tempo de glicose abaixo de 70 mg/dL nas aferições, bem como a aumento do percentual do tempo na meta de glicose de 70 a 180 mg/dL [5].
As principais limitações para o uso do monitoramento contínuo envolvem custo, necessidade de treinamento adequado do profissional prescritor, exposição do paciente à ansiedade por sobrecarga de dados/alerta, reações cutâneas pela presença do sensor e falhas tecnológicas.
Em caso de aferições incongruentes pelo dispositivo contínuo (por exemplo, glicose muito baixa em paciente assintomático), deve ser feita verificação manual com a glicemia capilar.
O risco de hipoglicemia também influencia na escolha da insulina. Pacientes com risco aumentado de hipoglicemia se beneficiam dos análogos de insulina de ação lenta/ultra-lenta (detemir, glargina e degludeca) em detrimento da NPH (para ver mais sobre insulinização basal, veja o tópico sobre insulina semanal. A mesma recomendação é válida para análogos de insulina ultra-rápida (aspart, lispro), em detrimento de insulinas de ação rápida (regular).