Síndrome da Antidiurese Inapropriada (SIAD)
A síndrome da antidiurese inapropriada (SIAD) é a causa mais frequente de hiponatremia. Em outubro de 2023, foi publicada do New England Journal of Medicine uma revisão sobre o tema [1]. Esse tópico traz os principais pontos da revisão.
O que é a síndrome da antidiurese inapropriada?
A síndrome da antidiurese inapropriada (SIAD) é uma síndrome clínica causada pelo aumento de atividade do hormônio antidiurético (ADH), sem que existam estímulos osmóticos ou volêmicos [2]. Pelo aumento da reabsorção de água livre pelos túbulos renais, o paciente desenvolve um quadro de hiponatremia e suas possíveis complicações.
Os pacientes com SIAD não apresentam alterações significativas da volemia. Esse quadro difere da hiponatremia hipervolêmica (como na insuficiência cardíaca ou cirrose) e da hiponatremia hipovolêmica, situações em que a hipersecreção do ADH é considerada “apropriada” já que o volume arterial efetivo está reduzido.
A hiponatremia acontece em 15 a 30% dos pacientes internados e 1,7 a 7,7% da população geral [3]. Os idosos possuem maior risco de hiponatremia e estima-se uma prevalência de até 40% nesta população [2].
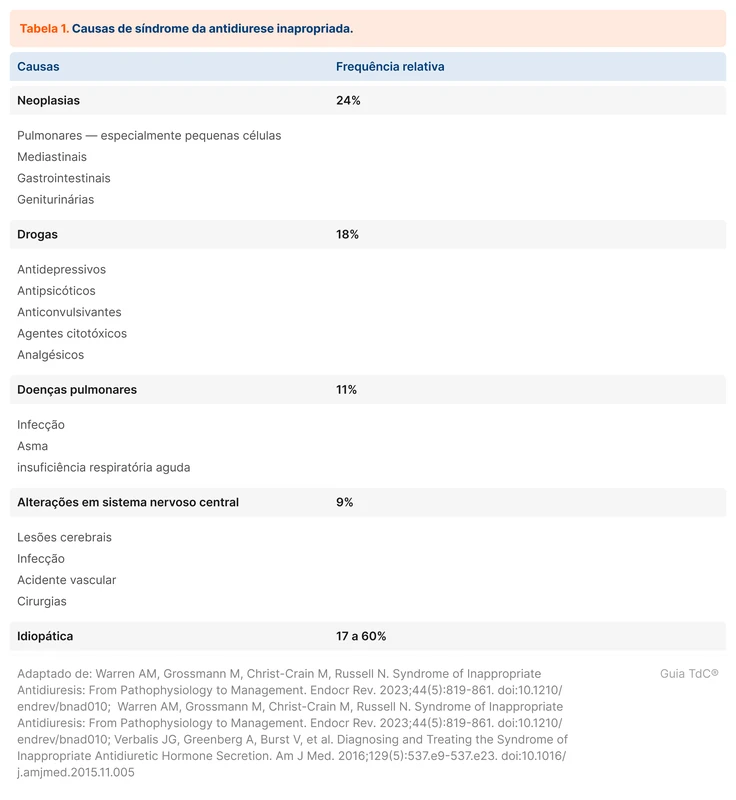
A SIAD aparece como a causa mais comum de hiponatremia em estudos observacionais, representando cerca de 35 a 40% dos casos [3]. Muitas condições podem evoluir para SIAD. A tabela 1 resume as principais causas.
Diagnóstico
A confirmação de SIAD exige o preenchimento de critérios (tabela 2) e a exclusão de diagnósticos diferenciais.

O primeiro passo para o diagnóstico é a confirmação da hiponatremia hipotônica, também chamada de hiponatremia verdadeira [3]. A hiponatremia verdadeira deve ser distinguida de duas condições:
- A pseudo-hiponatremia, quando o sódio aparece erroneamente reduzido por artefatos laboratoriais, mas a osmolaridade medida é normal,
- A hiponatremia por translocação, quando outro soluto osmoticamente ativo (como a glicose) causa a alteração laboratorial.
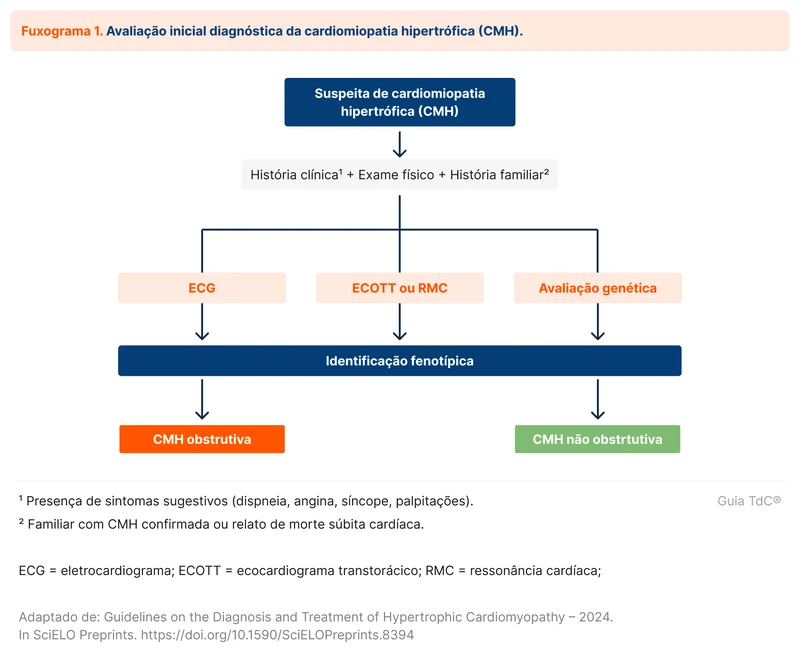
A SIAD ocorre em pacientes euvolêmicos, porém a avaliação da volemia pode ser difícil. Alternativas que auxiliam no diagnóstico de SIAD incluem a avaliação da osmolaridade e do sódio urinários. Um algoritmo diagnóstico para investigar SIAD pode ser utilizado (fluxograma 1).
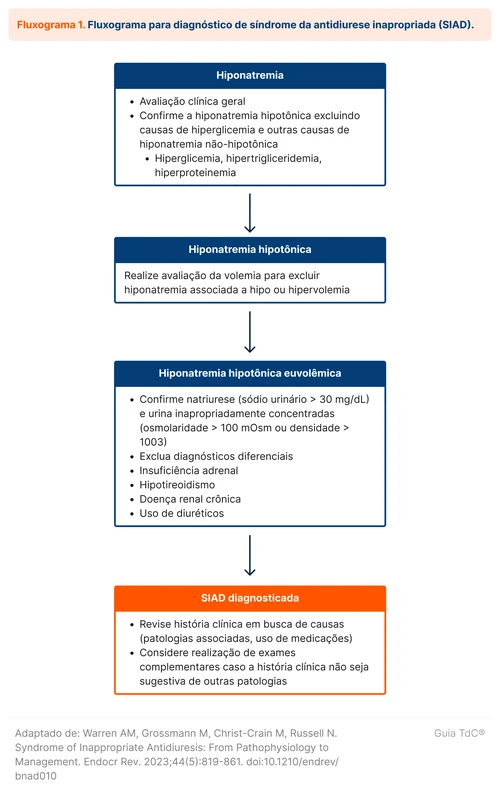
A partir da confirmação da SIAD, deve ser investigada a causa da síndrome (tabela 1). Muitas vezes, a etiologia pode ser determinada apenas com anamnese e exame físico, como em pacientes com sinais sugestivos de doenças pulmonares, alterações no sistema nervoso central ou uso de medicações. Exames complementares são solicitados conforme a suspeita principal, mas alguns especialistas sugerem a realização de tomografia de crânio e tórax como rastreio [2].
Tratamento
O primeiro passo do tratamento da SIAD é avaliar a necessidade de correção rápida dos níveis de sódio [3]. O tópico Hiponatremia na Emergência revisa o manejo da hiponatremia, incluindo as estratégias terapêuticas e os alvos. A correção rápida é indicada na presença de [2]:
- Sintomas graves (sonolência, crises convulsivas ou coma);
- Sintomas moderados (vômitos, confusão mental) com risco de progressão da hiponatremia (estado pós-operatório, hiponatremia induzida pelo exercício);
- Doenças intracranianas em que o risco de edema cerebral associado à hiponatremia pode trazer consequências.
Os quadros não graves de hiponatremia representam 95% dos casos e não necessitam de tratamento emergencial [2]. Para esses pacientes, o foco é a identificação e reversão da condição causadora da SIAD. Quando essa reversão não é possível ou quando uma causa básica não é identificada, as quatro medidas básicas abaixo são recomendadas, geralmente realizadas em contexto ambulatorial (tabela 3) [3, 4].
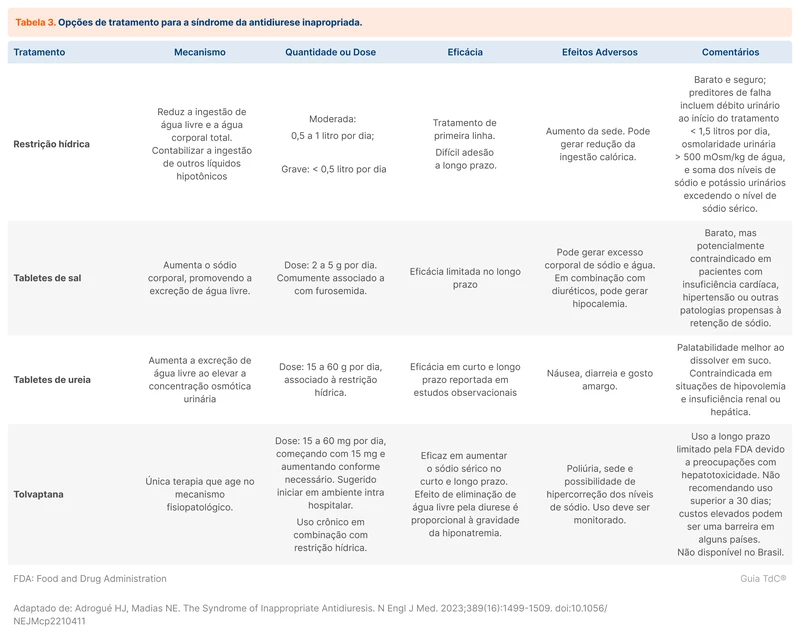
Restrição hídrica
Restrição hídrica é a primeira conduta diante de um paciente assintomático com SIAD [3, 4] . Essa recomendação é justificada por ser uma terapia de fácil introdução e baixo custo. Uma opção sugerida é a restrição de 500 ml a menos do que o débito urinário. Na maioria dos estudos, valores fixos de restrição (ex: 500 a 1000 ml) foram utilizados [2]. Existem poucas evidências que embasam essa conduta e a efetividade da intervenção, isoladamente, é limitada. O impacto na qualidade de vida do paciente pode limitar a adesão à terapia de restrição hídrica.
Tabletes de sal
A suplementação de sais pela via oral é uma alternativa terapêutica. O aumento da ingesta de sal incrementa a reserva corporal de sódio e atua como meio para a excreção de água livre. Diuréticos de alça também podem ser associados. De forma prática, a recomendação é a reposição de 2 a 5 g de sal por dia [3].
Tabletes de ureia
O mecanismo do funcionamento da ureia é semelhante ao de altas doses de cloreto de sódio. Altas concentrações de ureia no filtrado glomerular induzem diurese osmótica, reduzem a natriurese e aumentam a excreção de água livre. Os estudos que embasam essa terapia são pequenos e, em sua maioria, observacionais. A ureia não é facilmente disponível no Brasil. Como alternativa, o aumento da ingesta proteica para aproximadamente 1g/kg de peso pode gerar efeitos semelhantes, apesar de ainda faltarem evidências para apoiar essa conduta [2].
Tolvaptana
Os antagonistas do receptor V2 da vasopressina bloqueiam a ação do ADH no néfron distal, promovendo excreção de água livre. Assim, eles atuam no mecanismo fisiopatológico da SIAD. A principal representante da classe é a tolvaptana, disponível em opções orais em outros países, mas ainda não aprovada no Brasil [3, 4].