Controle de Glicemia no Paciente Internado
Hiperglicemia hospitalar está associado a piores desfechos e maior risco de complicações. Em julho de 2024, a Sociedade Brasileira de Diabetes (SBD) publicou uma diretriz com recomendações práticas sobre hiperglicemia em pacientes não críticos no hospital [1]. A Society of Critical Care Medicine (SCCM) também trouxe atualizações sobre metas e indicações do controle glicêmico no paciente crítico [2]. Este tópico aborda o controle de glicemia no paciente internado.
Controle de glicemia no paciente crítico
Hiperglicemia é comum em pacientes críticos, em parte por uma reação ao estresse fisiológico de uma doença grave. É um marcador de gravidade do quadro, com associação com morbidade e mortalidade. Apesar disso, os estudos não encontraram benefício de um controle intensivo de glicemia na UTI, porém essa estratégia resultou em maior incidência de hipoglicemia [3, 4].
A recomendação mais habitual é intervir quando há valores persistentemente acima de 180 mg/dL [5]. A meta é manter a glicemia entre 140 e 180 mg/dL. A Society of Critical Care Medicine (SCCM) traz uma atualização nos valores, estabelecendo um alvo glicêmico de 140 e 200 mg/dL, com objetivo de reduzir o risco de hipoglicemia [2]. Alguns estudos mais recentes colocaram como limiar para intervenção um valor máximo de 215 mg/dL, refletindo a ausência de benefício com controles mais intensivos e maior chance de hipoglicemia com essa abordagem [6, 7].
A insulina no paciente crítico pode ser realizado por via intravenosa contínua ou por via subcutânea intermitente [8]. Não há uma padronização sobre qual regime de insulinização deve ser instituído inicialmente. A maioria das instituições tem protocolos próprios, contendo geralmente a infusão contínua de insulina com monitorização glicêmica em intervalos de até uma hora. A diretriz da SCCM ressalta que a preferência por insulina intravenosa é uma recomendação fraca e com incerteza, pontuando que o alvo glicêmico é mais facilmente atingido com infusão contínua, porém com maior risco de hipoglicemia. Pacientes com hipoperfusão, drogas vasoativas ou edema significativo geram dúvidas quanto a absorção de insulina subcutânea.
Após controlar a doença aguda e atingir o alvo glicêmico com estabilização da taxa de infusão de insulina, recomenda-se a transição do esquema de tratamento para a via subcutânea.
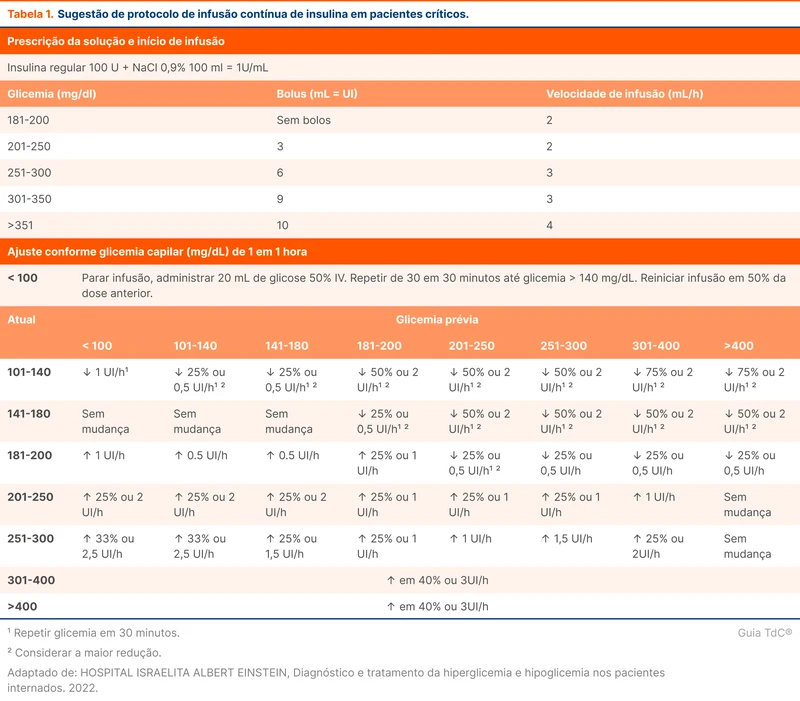
Exemplos de protocolos de insulinização intravenosa pode ser vistos na tabela 1 ou nos links abaixos:
Paciente não crítico: como monitorizar e quais os esquemas possíveis
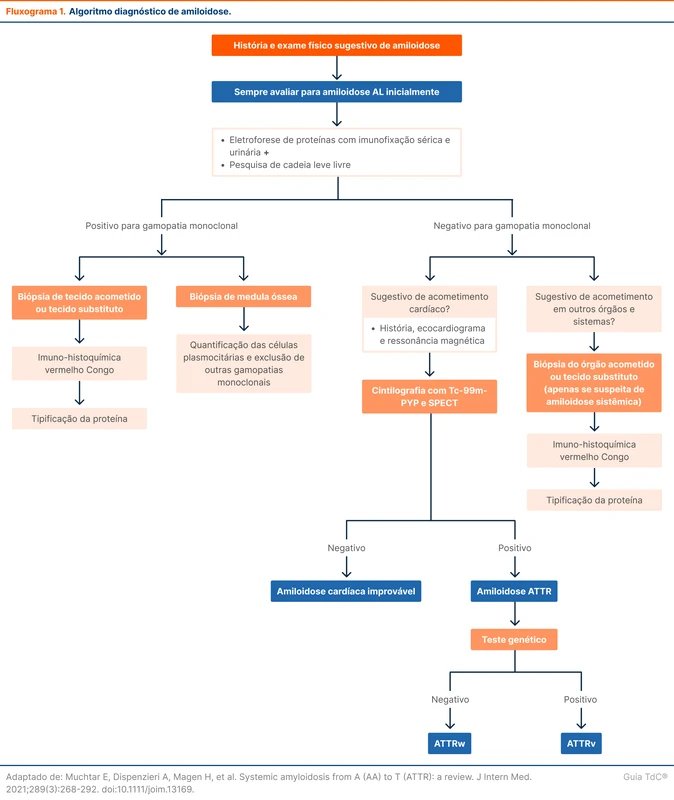
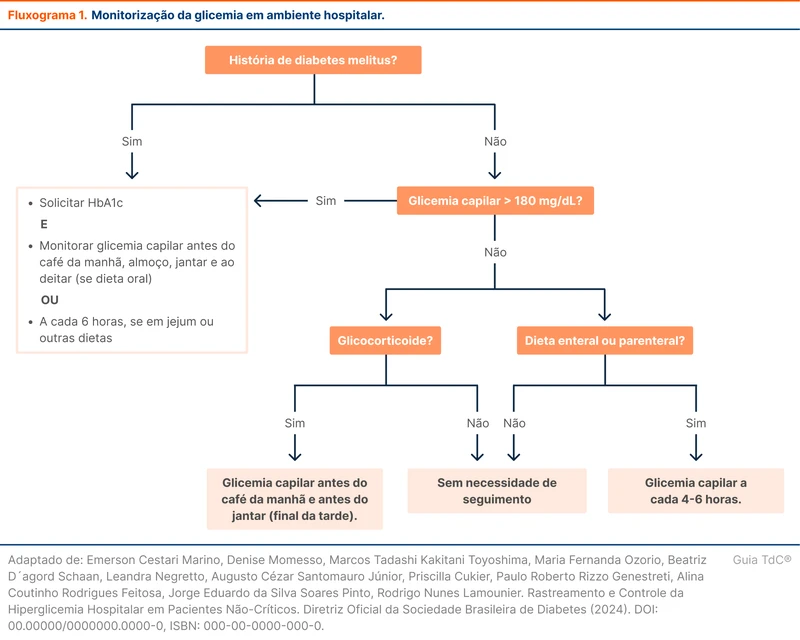
No paciente não crítico, hiperglicemia hospitalar é definida quando a glicemia é superior a 140 mg/dL. No entanto, valores acima de 180 mg/dL estão mais associados a complicações. A diretriz de 2024 da SBD define que duas ou mais glicemias acima de 180 mg/dL em 24 horas necessitam de controle glicêmico. O fluxograma 1 exibe a recomendação de monitorização da glicemia segundo a SBD nos diferentes perfis de pacientes [1].
A meta glicêmica recomendada pela diretriz da SBD é um alvo entre 100 - 180 mg/dL, com objetivo de evitar hiper e hipoglicemia. Para atingir esse controle há diversas estratégias que envolvem associação das insulinas basais (lentas) e bolus (rápidas) e aplicação nos seguintes esquemas:
- Escala de correção: apenas insulinas rápidas conforme glicemias pré-prandiais.
- Basal-plus: insulina basal com uso da escala de correção de glicemia pré-prandial [9].
- Basal-bolus: insulina basal, doses fixas de insulina rápida pré prandial associado a escala de correção de glicemia pré-prandial, se houver hiperglicemia pré-prandial [10].
A escolha do esquema de insulina depende do grau da hiperglicemia, histórico de uso domiciliar de insulina, presença de doenças prévias e uso de corticoides. O fluxograma 2 detalha a escolha do esquema de insulina conforme a SBD. Nos pacientes que não usam insulina domiciliar e que por algum motivo apresentam valores isolados de glicemia superiores a 180 mg/dL, pode ser optado pela escala de correção pré-prandial. Se a hiperglicemia for persistente (dois ou mais episódios em 24 horas) deve-se seguir as sugestões do fluxograma 2.
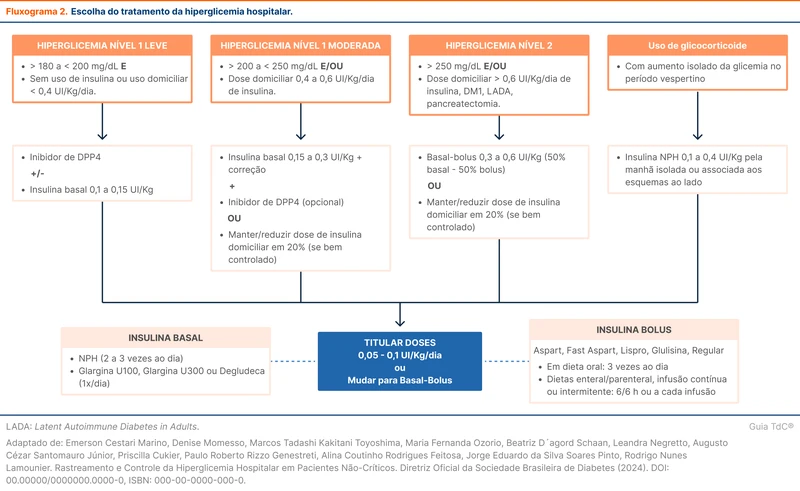
Na prescrição da escala de correção, as doses de insulina rápida devem considerar os perfis de paciente e a sensibilidade à insulina. Aumenta-se a dose de correção da glicemia quanto mais resistente à insulina for o paciente, conforme a tabela 2.
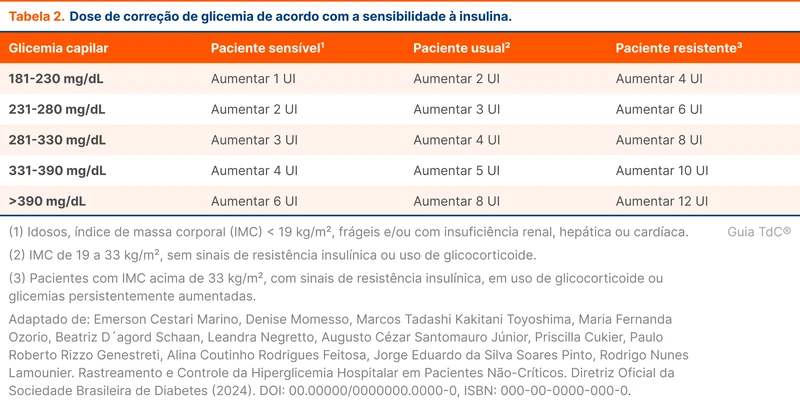
A tabela 3 detalha como utilizar o esquema basal bolus. O primeiro passo é calcular a dose total diária de insulina e 50% desse total irá corresponder a dose de insulina basal. A outra metade será de insulina rápida em 2 a 3 doses diárias conforme as refeições realizadas.

A diretriz brasileira acrescenta que os inibidores dipeptidil peptidase 4 (iDPP4) podem ser adicionados ao esquema para auxiliar o controle glicêmico.
Exemplo: paciente com DM2 em uso de metformina e gliclazida, IMC de 35, interna para biópsia excisional de linfonodo inguinal. No pós operatório apresenta repetidas glicemias acima de 300 mg/dL. Realizado HbA1c que demonstrou valor de 9,5%. Qual regime a ser instituído? A escala de correção deve ser ajustada?
Resposta: O paciente apresenta uma hiperglicemia nível 2 e com resultado de HbA1c que justifica início de um esquema basal-bolus (0,3 - 0,6 UI/Kg/dia) com aumento das doses de insulina de correção no período pré-prandial devido perfil de resistência à insulina aumentado.
Paciente não crítico: situações especiais
Pacientes em jejum com hiperglicemia não devem utilizar esquema basal-bolus pelo alto risco de hipoglicemia. Nesses casos, a preferência é pelo uso da escala de correção com a monitorização da glicemia capilar a cada 6 horas. Se a dieta for interrompida após a aplicação de uma insulina basal, deve-se infundir glicose endovenosa para minimizar o risco de hipoglicemia.
Nos pacientes que recebem dieta enteral ou parenteral, a prescrição de insulina basal segue os mesmos princípios do fluxograma 2. A dieta enteral pode ser administrada em infusão contínua ou intermitente. Na infusão intermitente, deve-se coordenar a aplicação das insulinas rápidas com os períodos alimentares. Na infusão contínua, a monitorização da glicemia capilar pode ocorrer a cada 6 horas e uso do esquema basal-plus (ou seja, insulina rápida apenas se escapes de hiperglicemia).
A hiperglicemia associada aos glicocorticoides se apresenta de duas formas: a hiperglicemia persistente (múltiplos valores >180 mg/dL ao longo do dia) e a hiperglicemia vespertina. Na hiperglicemia persistente, seguem-se as recomendações do fluxograma 2. Na hiperglicemia vespertina, a curva de alteração da glicemia é semelhante ao efeito da insulina NPH administrada pela manhã. Um esquema sugerido pela SBD é o uso da insulina NPH pela manhã, com a dose inicial 0,1 UI/Kg/dia para cada 10 mg de prednisona ou equivalente. A dose máxima inicial é 0,4 UI/Kg/dia, utilizada para pacientes em uso de 40 mg de prednisona ou mais. Essa recomendação se aplica apenas aos pacientes com predomínio de hiperglicemia vespertina [1].
A solicitação da hemoglobina glicada (HbA1c) durante a hospitalização ajuda a diagnosticar casos desconhecidos de DM e a guiar a conduta na alta hospitalar [11]. A prescrição de alta pode seguir da maneira abaixo:
- HbA1C < 8%: alta hospitalar com o mesmo esquema de tratamento utilizado antes da internação.
- HbA1C entre 8 a 10%: alta hospitalar com otimização do tratamento domiciliar prévio
- HbA1C > 10%: alta hospitalar com esquema basal-bolus ou uso de antidiabéticos orais associados a insulina basal.
Exemplo: paciente com doença pulmonar obstrutiva crônica recebendo 40 mg/dia de prednisona às 8 horas da manhã está apresentando hiperglicemias por volta das 17 horas sempre em valores entre 200 e 300 mg/dL. O que fazer
Resposta: Pode-se instituir um esquema de 0,4 UI/Kg/dia de insulina NPH a ser aplicada em dose única pela manhã ou associada a outras formas de insulinização caso apresente descontroles em outros momentos do dia.