Diretriz de Hemorragia Subaracnóidea Aneurismática da AHA/ASA
A hemorragia subaracnoidea aneurismática (HSAa) é o terceiro evento cerebrovascular mais comum, após AVC isquêmico e AVC hemorrágico parenquimatoso. Em maio de 2023, foi publicada a diretriz de HSA da American Heart e American Stroke Association (AHA/ASA)[1]. O tópico "Diretriz de Hemorragia Subaracnoidea Aneurismática da AHA/ASA" revisa o diagnóstico, classificação e tratamento da doença.
Diagnóstico de HSA
Hemorragia subaracnoide (HSA) é um sangramento para o espaço subaracnoideo. A ruptura espontânea de aneurismas cerebrais é a causa de HSA em até 85% dos pacientes [1],
HSA é uma suspeita na ocorrência de cefaleia súbita e intensa, também conhecida como cefaleia thunderclap ou “em trovoada”. Frequentemente, esse tipo de dor é relatada como “a pior dor de cabeça da vida”. Esse padrão de cefaleia pode ter outras causas e não é patognomônico de HSA. Perda de consciência, rigidez de nuca e déficit neurológico focal também podem estar presentes. Crises epilépticas ocorrem em 6% dos pacientes à admissão.
O exame de escolha para avaliação inicial é a tomografia de crânio (TC) sem contraste. Esse exame identifica sangramentos com sensibilidade de até 100% se realizada nas primeiras 6 horas do início dos sintomas [2]. O principal achado da tomografia é a presença de sangue, visualizado como uma imagem hiperdensa preenchendo os sulcos cerebrais ou os espaços liquóricos.
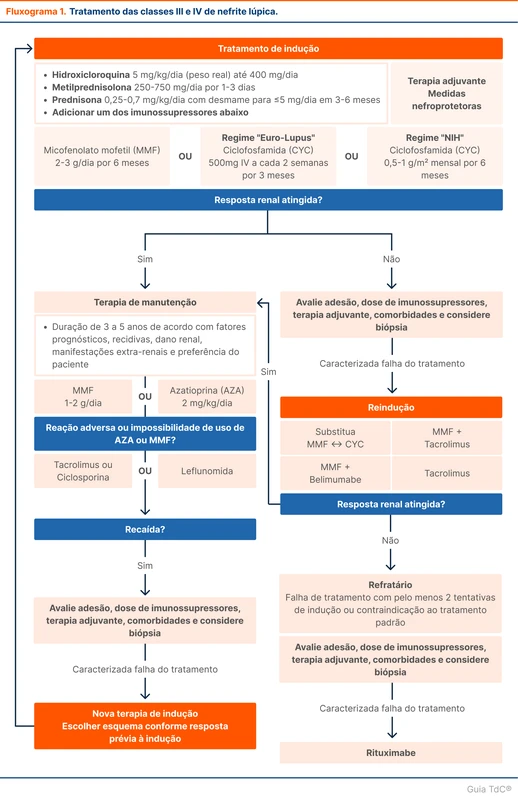
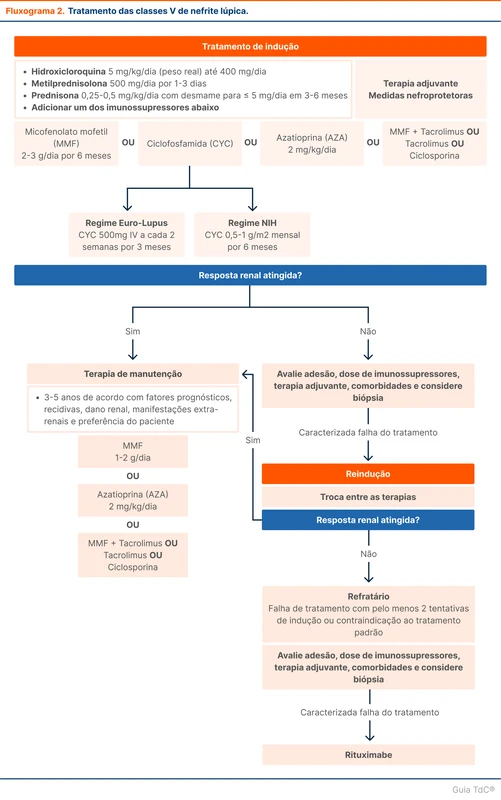
Em pacientes com mais de 6 horas do início dos sintomas e com TC de crânio duvidosa ou negativa, a punção lombar está indicada. O achado que sugere HSA é a xantocromia e presença de hemácias no liquor. Um confundidor comum é o acidente de punção, que também pode resultar em hemácias no liquor. Duas dicas ajudam a diferenciar essas duas condições:
- Na HSA, a coloração amarelada (xantocromia) é presente durante toda a coleta, sem diferença entre os tubos coletados (figura 1). Já no acidente de punção é esperado que a coloração predomine nos primeiros tubos.
- A presença de macrófagos hemáticos sugere HSA, sendo um reflexo da presença de sangue no espaço liquórico por tempo prolongado. Em acidentes de punção, geralmente não há esse achado.
Após o diagnóstico de HSA, é necessário avaliar a causa do sangramento. A etiologia mais comum de HSA é ruptura de aneurisma intracraniano e os principais sítios são a artéria cerebral anterior, a cerebral média e as artérias comunicantes. Para investigar a presença de um aneurisma, os exames complementares de escolha são a angiotomografia (angioTC) de crânio e a angiografia cerebral por cateter. Ambas têm boa acurácia diagnóstica, com a angiografia por cateter ainda permanecendo o exame padrão-ouro.
A angiorressonância magnética deve ser reservada para pacientes com contraindicações aos outros exames, pois tem menor acurácia diagnóstica, alto custo e difícil acesso.

Caso a investigação não encontre um aneurisma que justifique a HSA, é necessário buscar outras etiologias. A tabela 1 resume as principais causas e pistas clínicas de motivos não aneurismáticos para HSA.
Classificação de HSA e tratamento inicial
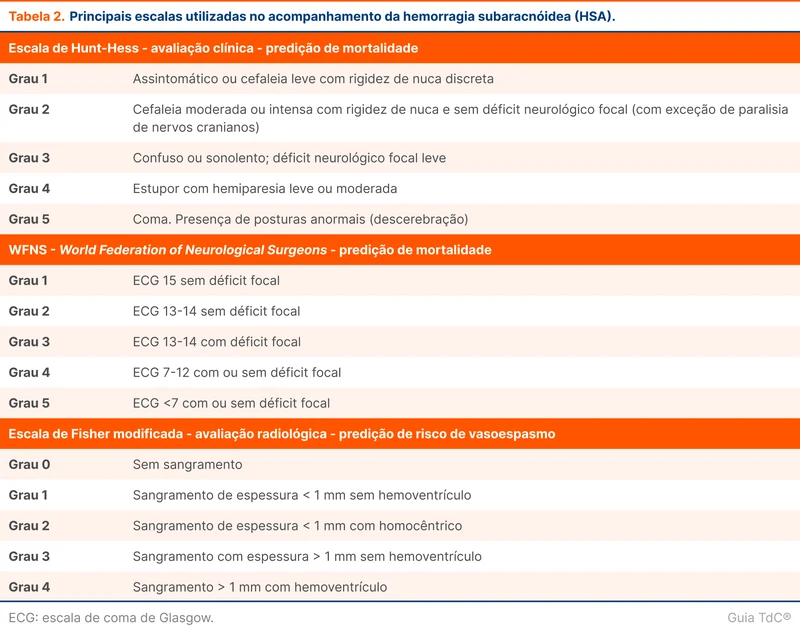
A primeira etapa na condução de um paciente com HSA é estabelecer o prognóstico por escalas padronizadas expostas na tabela 2. Todos os pacientes com HSA devem ser internados em UTI. Esses pacientes têm alta incidência de complicações precoces e tardias, sistêmicas e neurológicas, além de necessitarem de cuidados especializados e multidisciplinares que apenas a UTI pode fornecer.
Pacientes com discrasia sanguínea ou em uso de anticoagulantes devem corrigir imediatamente o distúrbio de coagulação, ou receber o respectivo antídoto ("Manejo de Sangramento Maior em Pacientes em Uso de Anticoagulante Oral"). Cerca de 30% dos pacientes podem apresentar aumento de troponina, arritmias e disfunção ventricular. Uma parcela menor de pacientes (até 5%) apresenta disfunção ventricular grave com repercussão hemodinâmica. Síndrome da antidiurese inapropriada (SIAD) ("Síndrome da Antidiurese Inapropriada (SIAD)") e síndrome cerebral perdedora de sal podem ocorrer em até 44% dos pacientes com HSA.
Controle de pressão arterial
Pacientes com HSA aneurismática e que ainda não abordaram o aneurisma, devem ter monitorização frequente da PA para evitar variabilidade pressórica. Tanto hipertensão como hipotensão são deletérias. A diretriz não faz recomendação de alvo específico de PA, mas recomenda infusão de vasodilatador intravenoso, visando à diminuição pressórica gradual, quando a pressão sistólica permanece acima de 180 mmHg. Já a pressão arterial média deve ser mantida acima de 65 mmHg.
Prevenção e tratamento de complicações da HSA
A abordagem cirúrgica ou endovascular do aneurisma deve ser realizada o mais rápido possível, preferencialmente em até 24 horas. As principais opções terapêuticas são a clipagem, realizada por cirurgia aberta, ou a embolização, realizada via endovascular.
Vasoespasmo e isquemia cerebral tardia
A principal complicação relacionada à HSAa é a isquemia cerebral tardia, que ocorre em até 30% dos pacientes. A incidência é maior entre 4 e 14 dias após a HSA, com pico na primeira semana. O vasoespasmo é considerado a principal causa de isquemia cerebral tardia e é caracterizado por uma estenose de artérias cerebrais. Acredita-se que o vasoespasmo ocorra pela liberação de substâncias durante a lise de sangue no espaço subaracnoide [3].
A suspeita de isquemia cerebral tardia surge quando ocorre piora neurológica [4]. A piora é definida como redução de dois ou mais pontos na escala de coma de Glasgow, ou aparecimento de um novo sinal neurológico focal com duração de pelo menos uma hora, que não seja atribuído a outras causas. Exames para pesquisa de vasoespasmo, como doppler transcraniano (DTC) ou angioTC intracraniana, devem ser realizados. Eletroencefalograma contínuo e TC com protocolo de perfusão também podem ser utilizados, mas são pouco disponíveis. No caso de exame neurológico limitado por coma, o DTC pode ser utilizado para rastreio de vasoespasmo.
O nimodipino é a principal conduta para prevenir o vasoespasmo e a isquemia cerebral tardia. A droga deve ser prescrita para todos os pacientes com HSA aneurismática, idealmente nas primeiras 24 horas. A dose é de 60 mg por via oral ou sonda nasoenteral a cada 4 horas. Usar vasopressores para elevar a pressão arterial na tentativa de prevenir vasoespasmo não deve ser realizado, pois essa conduta resultou em piores desfechos.
O tratamento envolve manutenção da euvolemia e a diretriz pontua a indução de hipertensão com drogas vasoativas como uma intervenção razoável. Não há consenso sobre como a hipertensão deve ser induzida e a noradrenalina é uma das drogas mais usadas [5]. Essa terapia deve ser feita apenas após a abordagem do aneurisma. Em caso de piora sintomática persistente ou estenose de grandes vasos, pode ser considerada intervenção via endovascular (angioplastia ou vasodilatador intra-arterial).
Crises epilépticas
Não é indicada a profilaxia primária de crises epilépticas. A prescrição de anticonvulsivantes por sete dias é recomendada como profilaxia secundária, ou seja, apenas se houver convulsão. A preferência é para fenitoína e levetiracetam. Veja mais sobre na revisão "Anticonvulsivantes".
Hidrocefalia
A hidrocefalia tem prevalência de 20 a 30% e pode ocorrer agudamente, nas primeiras 72 horas da HSA, ou tardiamente, após duas semanas do evento. A apresentação se dá com piora do nível de consciência e a TC mostra dilatação dos ventriculos cerebrais. A hidrocefalia aguda com deterioração clínica deve ser tratada com abordagem neurocirúrgica para derivação ventricular externa ou drenagem lombar de urgência. Enquanto os pacientes aguardam a derivação, a salina hipertônica pode ser utilizada para controlar a hipertensão intracraniana.