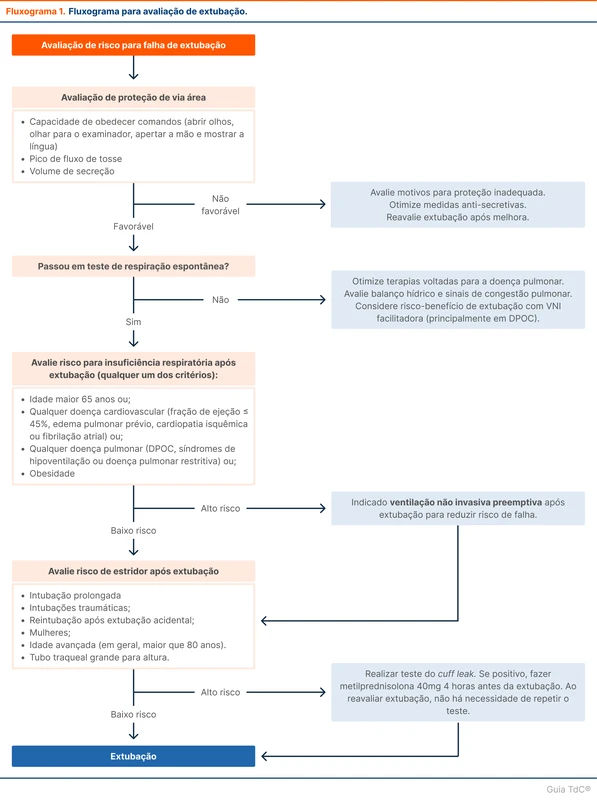
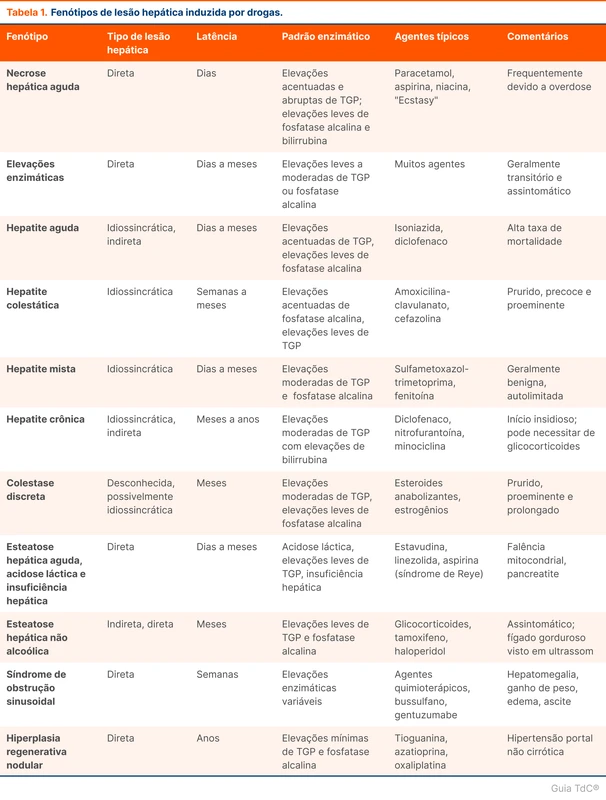
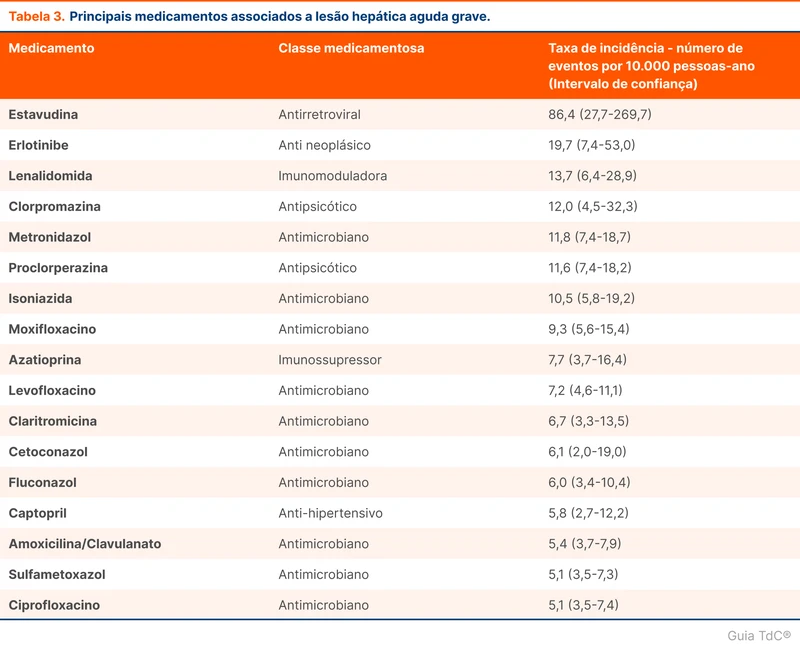
Mpox (Monkeypox)
A Organização Mundial da Saúde (OMS) declarou em agosto de 2024 que os casos de mpox (a antiga monkeypox) em países africanos são uma emergência de saúde pública de preocupação internacional. O tópico "Mpox" revisa o diagnóstico e o manejo dessa doença.
Situação atual
A mpox, antes chamada de monkeypox, é causada por um vírus do gênero Orthopoxvírus, similar à varíola. É transmitida por contato direto com lesões de pele ou fluidos corporais da pessoa infectada, incluindo contato sexual, contato com objetos e superfícies contaminados e com secreções respiratórias. A doença pode ser adquirida e transmitida para mamíferos. O tempo entre o contato e a manifestação dos sintomas é de 3 a 21 dias, com média de 7 a 9 dias [1, 2]. No surto de 2022, 95% dos pacientes eram homens que fazem sexo com homens.
O aumento de casos e o surgimento de uma nova variante de mpox levou a OMS a declarar emergência de saúde pública de preocupação internacional em 14 de agosto de 2024. A declaração visa mobilizar recursos internacionais, simplificar o financiamento e acelerar o desenvolvimento de vacinas, tratamentos e métodos diagnósticos sob autorização de uso emergencial. No Brasil, até o início de agosto de 2024, 709 casos foram registrados no Ministério da Saúde, predominando em São Paulo e Rio de Janeiro.
Apresentação clínica
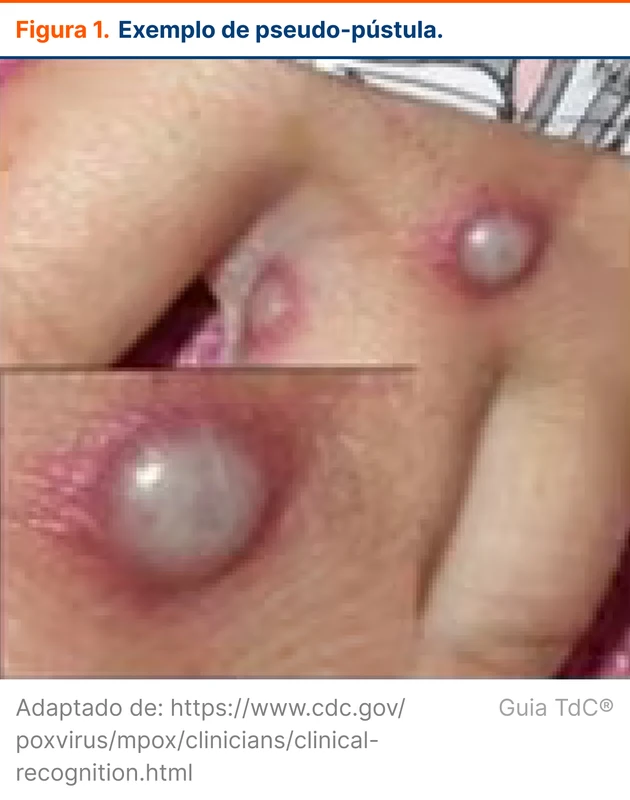
A lesão inicial aparece no local provável de inoculação. Começa como mácula, evoluindo para pápula, vesícula e depois para pseudo-pústulas (figura 1). As pseudo-pústulas são pápulas que se assemelham a pústulas, mas o conteúdo é sólido, ao invés de líquido e purulento [3]. O centro pode se tornar necrótico e eventualmente as lesões assumem um aspecto umbilicado. Ao final, as lesões evoluem para crostas.
As lesões ocorrem mais comumente nos genitais, face, braços, mãos e região perianal. Podem ser únicas ou múltiplas, com mais de 50% dos casos tendo de duas a dez lesões, e eventualmente surgem em estágios diferentes de desenvolvimento [4]. Os pacientes com frequência sentem dor no local e alguns precisam de internação hospitalar para analgesia. Lesões confluentes podem causar edema importante causando obstrução uretral e retal. Quadros disseminados são descritos em imunossuprimidos.
A lesão inicial pode se apresentar de formas diferentes, a depender da localização. Lesões em mucosas tendem a se manifestar como úlceras. Nos dedos, a lesão pode se apresentar como paroníquia (inflamação periungueal). A OMS e o Centers for Disease Control and Prevention (CDC) disponibilizam gratuitamente imagens de mpox (veja aqui as imagens de mpox da OMS e do CDC).
Sintomas sistêmicos estão presentes na maioria dos pacientes (80 a 95%), principalmente febre, mialgia, linfonodomegalia, dor de garganta e cefaleia [1, 5]. Os sintomas podem aparecer antes das lesões de pele em mais da metade dos casos. Manifestações graves como encefalite, pneumonia e miopericardite podem ocorrer em pacientes com HIV.
O diagnóstico é feito por detecção do vírus por reação em cadeia de polimerase quantitativa (qPCR). A coleta pode ser feita por swab em lesões de pele, orofaringe ou mucosas, assim como coleta da própria crosta para análise. Veja mais detalhes sobre o diagnóstico de mpox na nota informativa do ministérios da saúde. A suspeita de mpox é de notificação imediata, em até 24 horas.
Tratamento e prevenção
Deve-se adotar precauções de contato e gotículas com proteção ocular, máscara cirúrgica, avental e luvas descartáveis durante o cuidado de casos suspeitos ou confirmados de mpox. Máscara N95 ou equivalente deve ser adotada em procedimentos que gerem aerossóis. O caso confirmado de mpox deverá se manter em isolamento até que a erupção cutânea esteja totalmente resolvida, ou seja, até que todas as crostas tenham caído e uma nova camada de pele intacta tenha se formado. O tempo de transmissão médio em um estudo foi de 25 dias [6].
A maioria dos pacientes com mpox terá doença leve e podem ser tratados ambulatorialmente com suporte clínico. Os principais motivos de internação durante o surto de 2022 foram infecção bacteriana secundária, dor retal e perianal e acometimento ocular [5, 7].
O tecovirimat é um antiviral atualmente em investigação para o tratamento de mpox. Estudos pré-clínicos mostraram eficácia em modelos animais. A medicação foi usada em pacientes com mpox no surto de 2022, mas faltam estudos randomizados. O Centers for Disease Control and Prevention (CDC) dos Estados Unidos publicou um protocolo de acesso à medicação para imunossuprimidos, pacientes com manifestações graves ou em risco para manifestações graves. No Brasil, o Ministério da Saúde adquiriu uma pequena quantidade de medicação. Para obtê-la, deve ser realizado contato com mpox@aids.gov.br para avaliação técnica.
A vacinação contra mpox é recomendada para pessoas vivendo com HIV sendo homens cisgênero, travestis e mulheres trans com idade maior ou igual a 18 anos e profissionais de laboratório que trabalham diretamente com Orthopoxvírus. Pode ser usada também como profilaxia pós-exposição. No momento os estoques estão esgotados na maior parte dos estados. O Brasil está em negociação para aquisição de novas vacinas da mpox.