Bacteremia por Staphylococcus aureus
A bacteremia por Staphylococcus aureus tem uma mortalidade de 10 a 30% [1]. Indicação de ecocardiograma, necessidade de repetir hemoculturas e tempo de tratamento são dúvidas frequentes. Este tópico revisa as manifestações, abordagem inicial e tratamento dessa condição.
Tipos e características de bacteremia por S. aureus
Bacteremia é o crescimento de bactérias em hemocultura associado a um processo infeccioso. O termo infecção de corrente sanguínea (ICS) às vezes é usado na literatura médica como sinônimo de bacteremia, mas também inclui a presença de fungos na corrente sanguínea (fungemia). Os termos são usados de forma heterogênea. Com relação ao S. aureus, a terminologia mais comum é bacteremia [2].
As infecções por S. aureus podem ser divididas em:
- Infecções de pele e partes moles e pneumonia.
- Infecções associadas a dispositivos e pós-procedimento: infecção associada a cateter venoso central, dispositivo intracardíaco e infecção de sítio cirúrgico.
- Infecções secundárias à disseminação hematogênica: endocardite, osteomielite, pielonefrite, artrite, piomiosite, abscesso cerebral, abscesso intra-abdominal e outros abscessos.
Infecção metastática significa o espalhamento de uma infecção de um sítio primário para um sítio secundário. Como exemplo, um paciente com endocardite (sítio primário) pode evoluir com osteomielite vertebral e abscessos intra-abdominais (sítios secundários). O S. aureus consegue se aderir a tecidos e dispositivos, o que facilita essa complicação.
Um cenário possível é a identificação da bacteremia em pacientes com sintomas inespecíficos. O crescimento de S. aureus na hemocultura deve sempre ser considerado patogênico e não deve ser interpretado como contaminação. A partir desta cultura positiva, deve-se procurar um foco, mas em até 25% dos pacientes o foco não é encontrado [3].
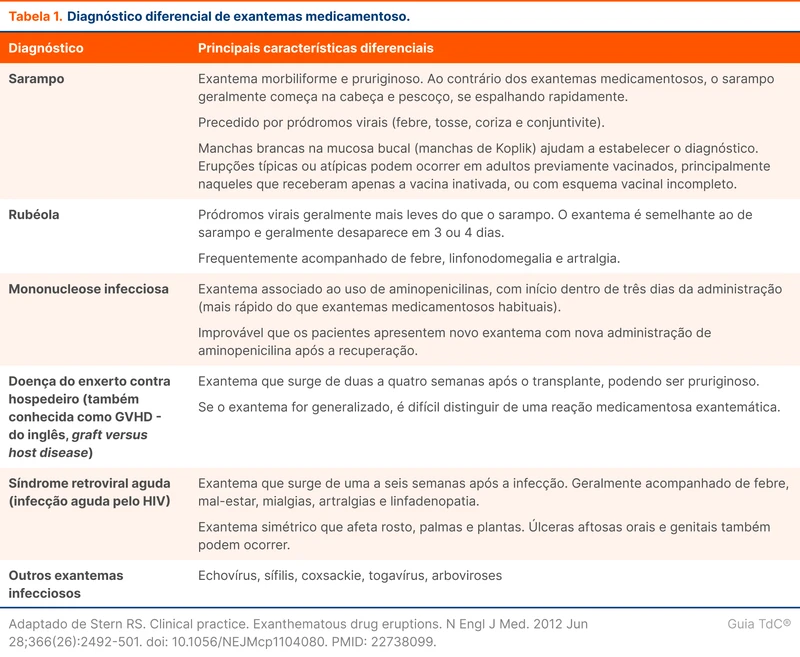
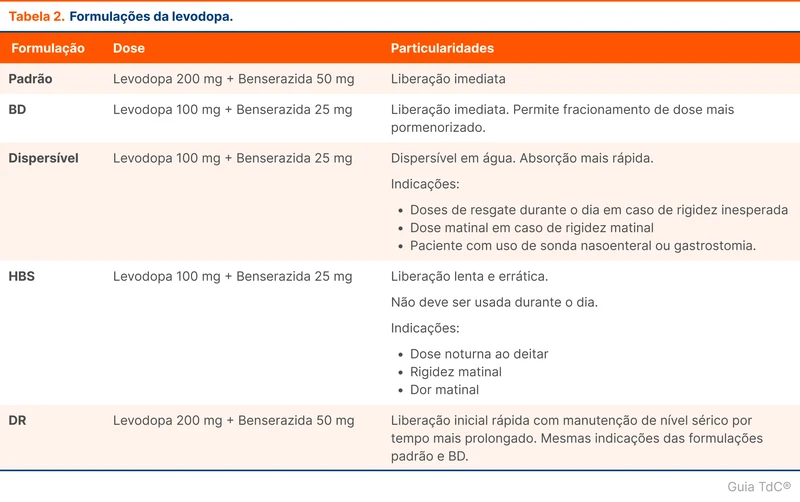
A bacteremia por S. aureus pode ser classificada em complicada e não complicada (tabela 1). O termo complicada é usado para pacientes que possuem fatores associados a maior mortalidade e morbidade, como presença de endocardite ou ausência de melhora clínica em 72 horas. Existe a recomendação de aumentar o tempo de tratamento em pacientes com esses fatores. Contudo, a divisão não é consensual e recentemente alguns autores sugerem que outros fatores devem ser considerados para determinar o tempo de tratamento [4].
Abordagem do paciente com bacteremia por S. aureus
Após a identificação da bacteremia, uma sugestão de avaliação é composta por quatro pontos: ecocardiografia, investigação de infecção metastática, repetição de hemoculturas e consulta com infectologista.
Ecocardiografia
É recomendado o rastreio de endocardite em todos os pacientes com bacteremia por S. aureus. A prevalência de endocardite nesses pacientes é de até 22%. Em pacientes com valva protética, a prevalência chega a 38% [5]. Estudos que utilizaram o ecocardiograma como rastreio de endocardite em pacientes com bacteremia por S. aureus encontraram a doença em pacientes sem sinais clínicos sugestivos.
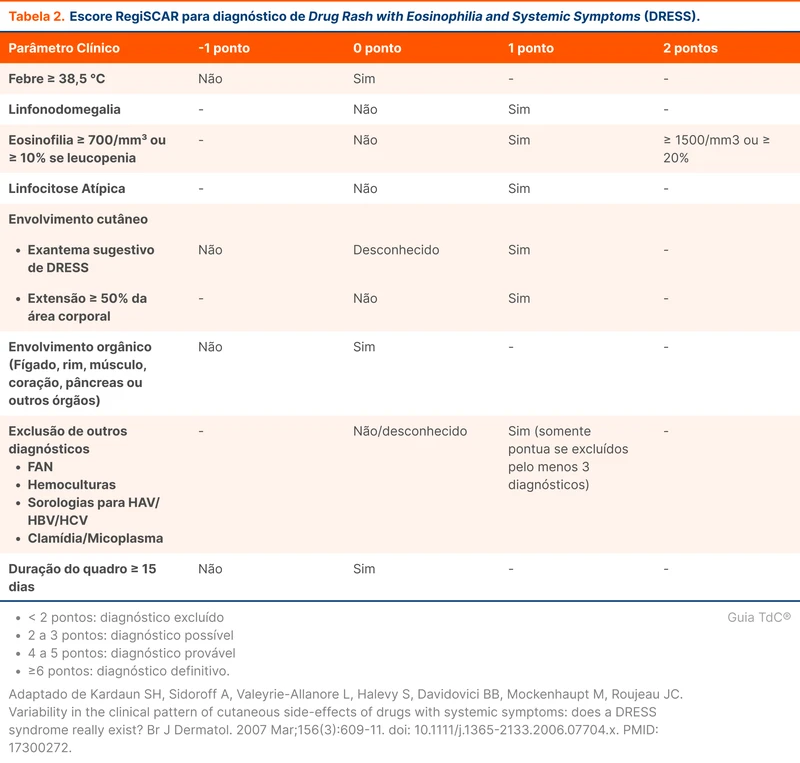
A técnica da ecocardiografia é motivo de discussão. O ecocardiograma transesofágico é mais sensível para o diagnóstico de endocardite, mas tem maior custo e risco [6-9]. Alguns escores foram criados para predizer o risco de endocardite e a necessidade de realização de ecocardiograma transesofágico [10, 11]. Desses escores, o mais sensível é o VIRSTA (tabela 2) com sensibilidade de 96% e valor preditivo negativo de 99% para excluir endocardite.

Confrontando o risco de não diagnosticar endocardite e o risco do procedimento, alguns autores criticam o uso desses escores, enfatizando o ecocardiograma transesofágico para todos [12]. Apesar disso, um estudo publicado no Clinical Infectious Disease em 2024 sugere que após estratificação de risco, pacientes de baixo risco podem não se beneficiar de exames de rastreio [13].
Investigação de infecção metastática
A investigação de focos metastáticos depende de manifestações clínicas. Como exemplo, pacientes com dor à palpação da coluna devem ser investigados para osteomielite vertebral e aqueles com dor abdominal devem ser avaliados para abscesso intra-abdominais [4, 14].
Não há recomendação direta de realizar fundoscopia em pacientes com bacteremia por S. aureus sem sintomas oftalmológicos. Dois fatores devem ser considerados para realizar fundoscopia em pacientes assintomáticos. Primeiro, a fundoscopia faz parte da investigação de endocardite (veja mais em "Novos Critérios de Duke para o Diagnóstico de Endocardite Infecciosa"). Segundo, em um estudo retrospectivo com 1109 pacientes, acometimento ocular foi encontrado em 9% dos pacientes com bacteremia por S. aureus e, entre aqueles que podiam reportar sintomas, apenas 36% relataram queixas visuais [15].
Repetição de hemoculturas
Hemoculturas seriadas auxiliam na avaliação do prognóstico. A persistência de cultura positiva após 72 horas está associada a piores desfechos e deve levantar a suspeita de infecção metastática. A frequência ideal de coleta não é bem definida, mas algumas referências sugerem repetir as hemoculturas a cada 2 a 4 dias e interromper a coleta após documentar a resolução da bacteremia [4].
Avaliação do infectologista
A maioria das referências sugere o acompanhamento conjunto com infectologista. Essa estratégia está associada a melhores desfechos [1, 4, 16].
Tratamento de bacteremia por S. aureus
O controle do foco infeccioso com intervenções cirúrgicas, desbridamento de tecidos desvitalizados, troca de dispositivos e drenagem de abscessos deve ser feito em todos os pacientes. O tratamento antimicrobiano depende do perfil de sensibilidade do S. aureus.
S. aureus sensível a meticilina (MSSA)
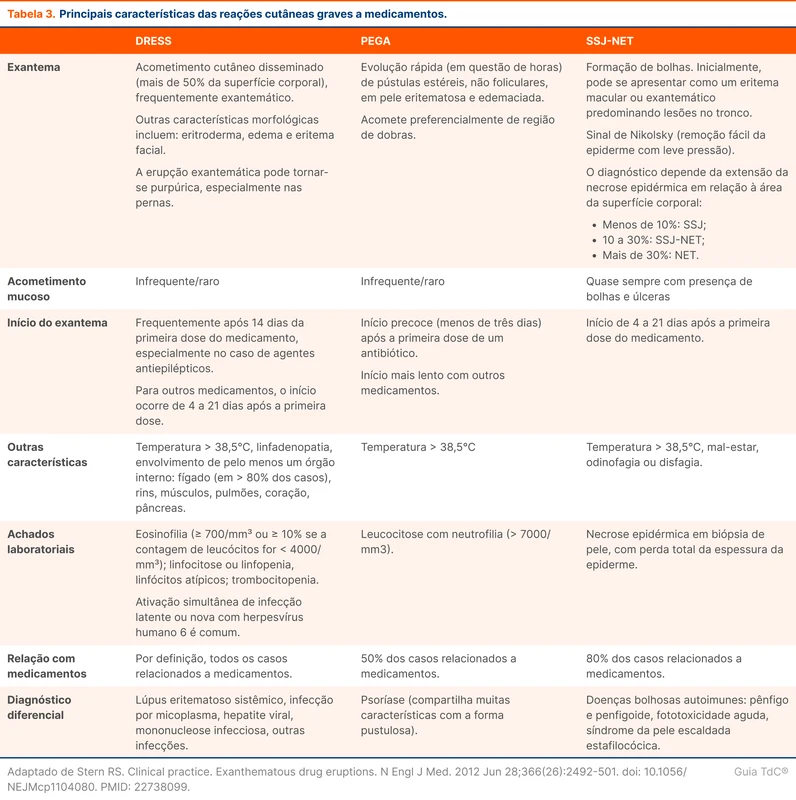
Cefazolina e oxacilina são as medicações de escolha para tratar bacteremia por MSSA (tabela 3). Alguns estudos sugerem que a vancomicina está associada a maior mortalidade quando comparada a beta-lactâmicos nesse cenário [4, 17, 18]. Entre cefazolina e oxacilina, estudos observacionais sugerem menor mortalidade com a cefazolina [19-21]. A cefazolina também está associada a menor nefrotoxicidade, hepatotoxiciade, reações de hipersensibilidade e menor taxa de descontinuação do tratamento por eventos adversos [22].

S. aureus resistente a meticilina (MRSA) e terapia empírica
Vancomicina, teicoplanina, linezolida e daptomicina são opções nessa situação. Veja mais sobre tratamento de MRSA em "Staphylococcus aureus Resistente à Meticilina (MRSA) e Vancomicina".
Antes do resultado do antibiograma, o paciente com hemocultura positiva para S. aureus ou com crescimento de cocos gram-positivos agrupados ainda sem diferenciação é tratado com um antimicrobiano baseado na possível sensibilidade do patógeno (terapia empírica). Há divergência em relação a qual o esquema antibiótico ideal nesse momento. Algumas referências sugerem um esquema com dois antibióticos, composto por vancomicina em conjunto com cefazolina ou oxacilina [14, 17]. Essa recomendação valoriza a vantagem da cefazolina e oxacilina em relação à vancomicina para tratamento de MSSA. Outras referências propõem o uso de vancomicina como monoterapia. Nesse caso, uma das justificativas é um estudo observacional com mais de 5000 pacientes, que não encontrou vantagem em adicionar outro antibiótico [18].
Duração do tratamento e transição para via oral
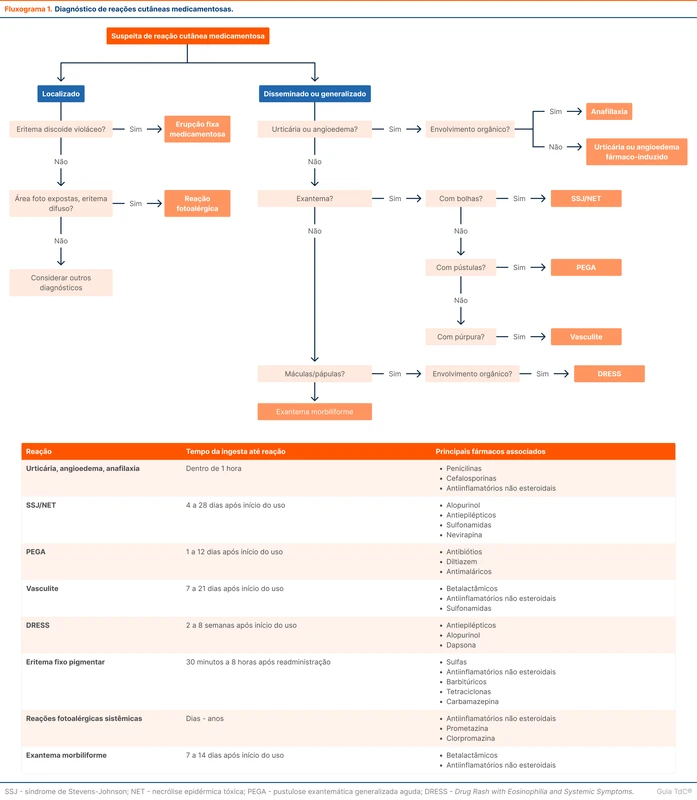
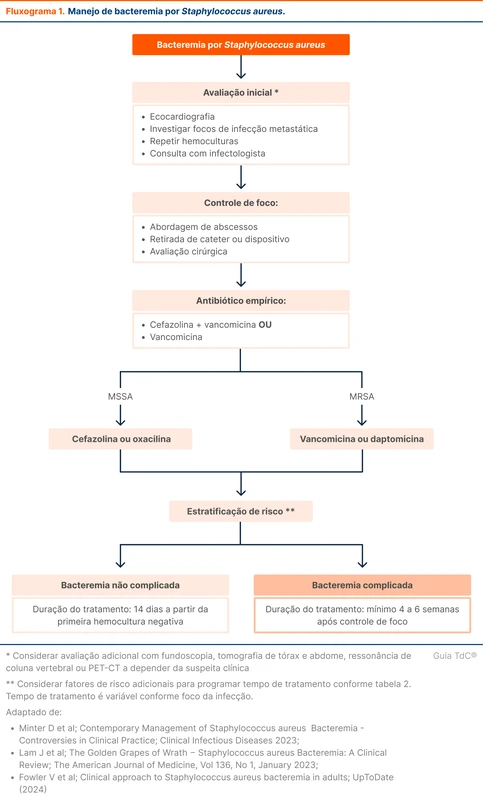
A duração do tratamento com antimicrobianos varia conforma a apresentação clínica. Para bacteremia não complicada, recomenda-se 14 dias de tratamento [4, 14, 23]. Novos estudos avaliando tempos menores de tratamento estão em curso [24]. Para bacteremias complicadas (por exemplo, com focos metastáticos ou endocardite), o tempo de tratamento recomendado é de 4 a 6 semanas após o foco ser considerado controlado [4, 14, 25]. Existe a recomendação de contar o tempo de tratamento a partir da primeira hemocultura negativa, mas não há evidência clara de melhores desfechos com essa conduta. O fluxograma 1 organiza a abordagem e tratamento da bacteremia por S. aureus.
A transição do antibiótico para a via oral nas bacteremias é assunto de muitos estudos atuais. Evidências recentes apontam para segurança e eficácia similares das terapias intravenosas e orais, sendo apropriado a troca para via oral uma vez que o paciente esteja estável e em condições de receber tratamento por essa via [4, 26, 27].