Diretriz de Doenças da Aorta - ESC 2024
A European Society of Cardiology (ESC) publicou em 30 de agosto de 2024 a nova diretriz de doenças da aorta e doenças arteriais periféricas [1]. A doença arterial periférica foi abordada em "Doença Arterial Periférica: Diretriz AHA/ACC 2024". Este tópico é baseado na nova diretriz e revisa o diagnóstico, rastreio, tratamento e atualizações sobre aneurismas de aorta.
O que é e como diagnosticar um aneurisma de aorta?
Aneurisma de aorta é um aumento do diâmetro da aorta em mais de 50% do predito para idade, sexo e superfície corporal total, utilizando curvas padrão. Um aumento do diâmetro acima de dois desvios padrão é denominado dilatação de aorta, também chamado de ectasia. Na prática, ectasia deve ser considerada se o diâmetro da raiz da aorta torácica for maior do que 4 cm em homens e de 3,6 cm em mulheres. Já na aorta abdominal, se o diâmetro for maior do que 3 cm, para ambos os sexos. A diretriz da American Heart Association (AHA) critica o termo “ectasia”, pontuando inconsistências na sua aplicação e definição, preferindo o termo “dilatação” [2]. A figura 1 mostra a anatomia da aorta e valores de normalidade.
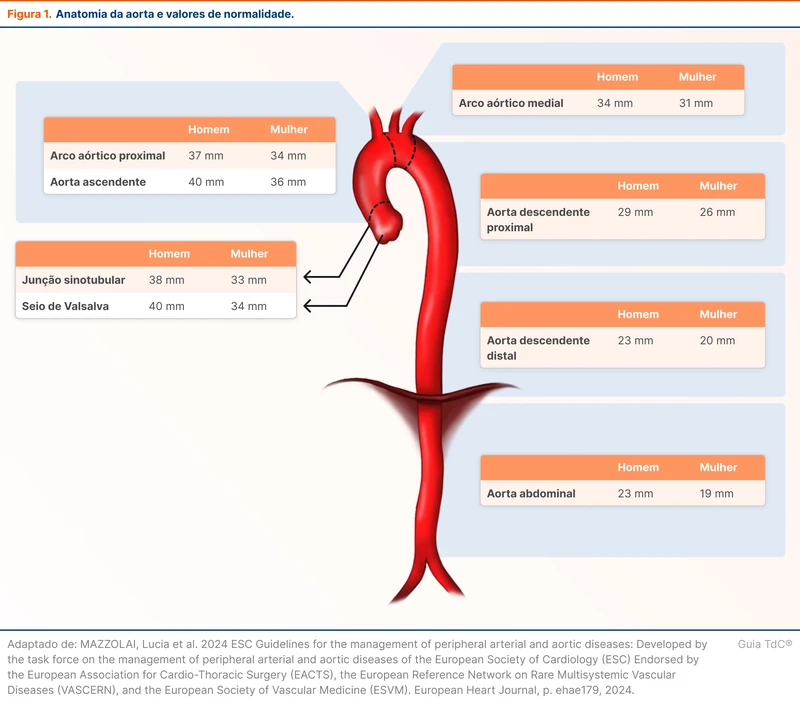
Em extremos de idade ou de superfície corporal, é recomendado o uso de curvas padrão e cálculo de desvios padrão. Valores de referência podem ser encontrados aqui [3].
Os aneurismas são classificados por localização (torácico ou abdominal) e morfologia (sacular ou fusiforme) e essas características se associam com causas e tratamentos distintos. Aneurismas saculares estão relacionados a infecções, úlcera aórtica penetrante, trauma e doenças inflamatórias. Já aneurismas fusiformes estão relacionados à aterosclerose e doenças do tecido conjuntivo.
Os aneurismas costumam ser assintomáticos. Quando há sintomas, é necessário investigar complicações. O aneurisma de aorta torácica (AAT) pode causar dor torácica, insuficiência da valva aórtica ou compressão de estruturas próximas. O aneurisma de aorta abdominal (AAA) é sintomático principalmente quando há ruptura e pode causar dor abdominal ou lombar aguda e sinais de choque hipovolêmico.
A ultrassonografia (USG) é o método mais disponível, rápido, barato e seguro para diagnóstico e monitoramento. O ecocardiograma transtorácico é utilizado para avaliação da raiz da aorta e valva aórtica. O ecocardiograma transesofágico é mais acurado que o transtorácico e avalia melhor a aorta torácica. A USG com doppler abdominal avalia a aorta abdominal.
Um aumento de 0,3 cm entre exames de USG é considerado uma variação significativa e deve ser confirmado por tomografia computadorizada (TC) ou ressonância magnética (RM). TC e RM são os métodos mais acurados e permitem avaliar a aorta em todo o seu trajeto.
Ao detectar um aneurisma de aorta, todo o trajeto do vaso deve ser avaliado. Em torno de 20% a 30% dos pacientes com aneurisma da aorta abdominal também têm aneurisma de aorta torácica [4, 5]. Nos casos de aneurisma de aorta torácica, deve-se avaliar também a função da valva aórtica.
Rastreio de aneurismas de aorta
A diretriz da ESC faz as seguintes recomendações:
- O rastreio de AAA com USG é recomendado em homens de 65 anos ou mais com história de tabagismo para reduzir o risco de morte por ruptura do AAA (nível de evidência A)
- O rastreio de AAA com USG pode ser considerado em homens com 75 anos ou mais (independente da história de tabagismo) ou em mulheres de 75 anos ou mais que são tabagistas ou possuem hipertensão (nível de evidência C)
- O rastreio familiar de AAA com USG é recomendado para parentes de primeiro grau de um paciente com AAA que tenham 50 anos ou mais, especialmente irmãos, exceto se uma causa adquirida seja claramente identificada (nível de evidência C).
A United States Preventive Services Task Force (USPSTF) recomenda o rastreio de AAA com USG para homens assintomáticos, de 65 a 75 anos, que já fumaram pelo menos 100 cigarros na vida. O rastreio é único, feito apenas uma vez.
Não há recomendação de rastreio de aneurismas de aorta torácica na população geral.
Epidemiologia e fatores de risco
Tanto AAA como AAT podem estar relacionados à aterosclerose e hipertensão arterial. Síndromes genéticas como Marfan, Ehlers-Danlos e Turner estão associadas a aneurismas torácicos ou toracoabdominais [6-8].
Os AAT podem acometer a raiz da aorta (porção que conecta o vaso ao ventrículo esquerdo), a porção ascendente e a descendente. Os AAT de raiz ou de aorta ascendente correspondem a 60% dos AAT. Aneurismas de raiz de aorta ocorrem em pacientes mais jovens e há mais complicações como insuficiência aórtica. Estão associados à valva aórtica bicúspide em 20 a 30% dos casos. Podem ser idiopáticos, associados a doenças genéticas ou causados por doenças que causam aortite como sífilis, arterite de Takayasu e arterite de células gigantes.
Os AAT descendentes e toracoabdominais são mais frequentemente degenerativos por calcificação. Outras causas são infecções, trauma, vasculites e doenças genéticas. O crescimento estimado é de 0,19 cm a 0,34 cm ao ano.
Já os AAA em sua maioria estão associados à aterosclerose e tem aspecto fusiforme. Os principais fatores de risco são tabagismo, sexo masculino e história familiar. O crescimento é estimado em torno de 0,3 cm ao ano e o risco de ruptura é maior em mulheres. Em 25% dos casos, o AAA se estende para as ilíacas comuns e até 20% se associam a aneurismas femorais ou poplíteos.
Quando e qual intervenção indicar nos aneurismas de aorta?
As complicações mais graves de um aneurisma de aorta são ruptura e dissecção aórtica. A intervenção cirúrgica deve ser indicada em pacientes de alto risco dessas complicações. Os principais fatores de risco são o tamanho do aneurisma e a taxa de crescimento, mas a diretriz utiliza o tamanho como principal fator para recomendar o tratamento.
Há recomendação contra revascularização coronariana antes da cirurgia eletiva de aorta em pacientes com sintomas cardíacos estáveis por ausência de benefício dessa estratégia.
Aneurismas de aorta torácica
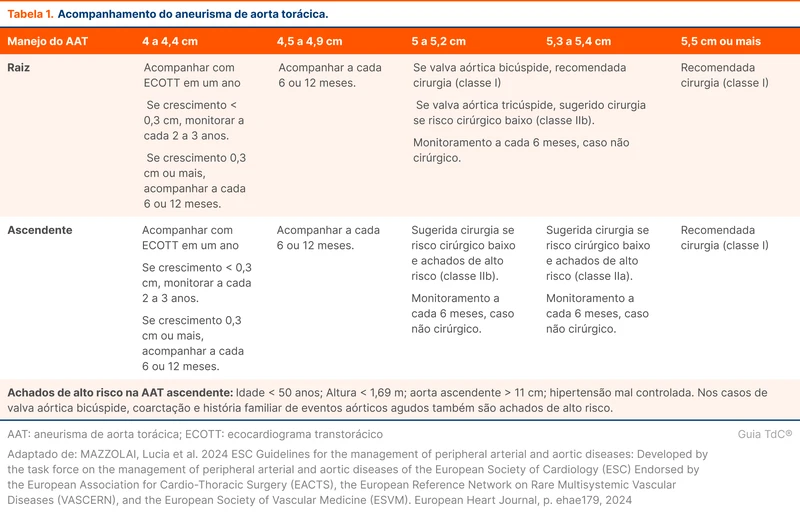
A cirurgia é recomendada a partir de 5 cm ou mais, sendo uma recomendação forte nos maiores de 5,5 cm. O acompanhamento de aneurismas de aorta torácica está na tabela 1. Para aneurismas da raiz, porção ascendente ou arco da aorta, a cirurgia aberta é a intervenção recomendada. Nos casos de doença valvar aórtica, a cirurgia de Bentall pode ser realizada, quando são substituídas a raiz da aorta e a valva. Em aneurismas da aorta descendente, o tratamento recomendado é endovascular.
Aneurismas de aorta abdominal
A cirurgia é recomendada a partir de 5,5 cm em homens e 5,0 cm em mulheres. Não há benefício de procedimento cirúrgico em aneurismas menores. Não é recomendado o procedimento eletivo em pacientes com sobrevida menor do que 2 anos. O acompanhamento de aneurismas de aorta abdominal está na tabela 2 [9-14].

Tanto o tratamento cirúrgico aberto quanto o endovascular são opções de tratamento. A cirurgia aberta preferível é a laparotomia com clampeamento e enxerto de dacron. O tratamento endovascular com endoprótese tem mortalidade perioperatória menor, abaixo de 1%, mas há maior chance de re-intervenção a longo prazo [15]. A vantagem de sobrevida da intervenção endovascular ocorre principalmente nos primeiros 8 anos. O tratamento endovascular é preferível em emergências, como ruptura de aorta.
Aneurismas toracoabdominais
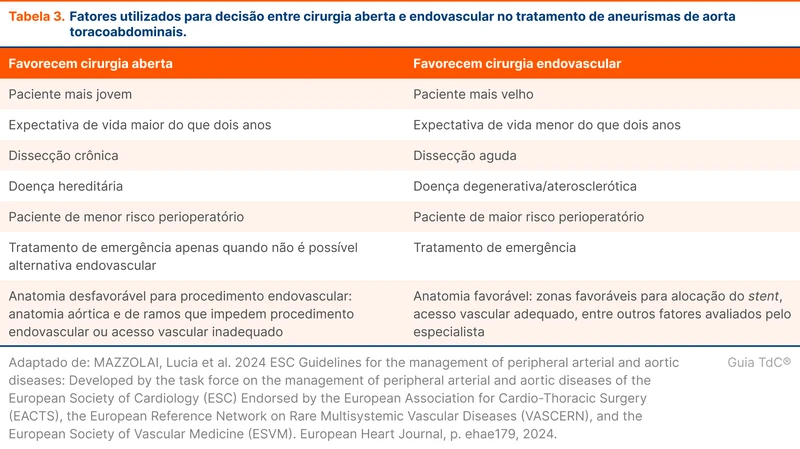
A abordagem de aneurismas toracoabdominais é variável e depende de fatores descritos na tabela 3.
Tratamento clínico dos aneurismas de aorta
Exercício físico e cessação do tabagismo são recomendados para todos. O controle da dislipidemia é indicado quando o aneurisma é causado por aterosclerose. É incerto o benefício de antiagregantes como a aspirina ou clopidogrel, mas é frequente a presença de comorbidades que indiquem o uso.
A ESC recomenda o controle de pressão arterial com alvo menor 120/80 mmHg, se tolerados. É razoável priorizar os inibidores da enzima de conversão da angiotensina (IECA), bloqueadores de receptores da angiotensina (BRA) e betabloqueadores como primeira linha, apesar de poucas evidências nesse cenário. A evidência para uso de betabloqueadores é de estudos na síndrome de Marfan [16].
As fluoroquinolonas parecem aumentar o risco de aneurisma de aorta e de dissecção de aneurisma, mas existe controvérsia sobre essa relação [17-19]. A diretriz sugere evitar a medicação em situações em que haja uma alternativa igualmente eficaz. Caso clinicamente indicado, o documento recomenda o uso independente da presença de doenças da aorta.