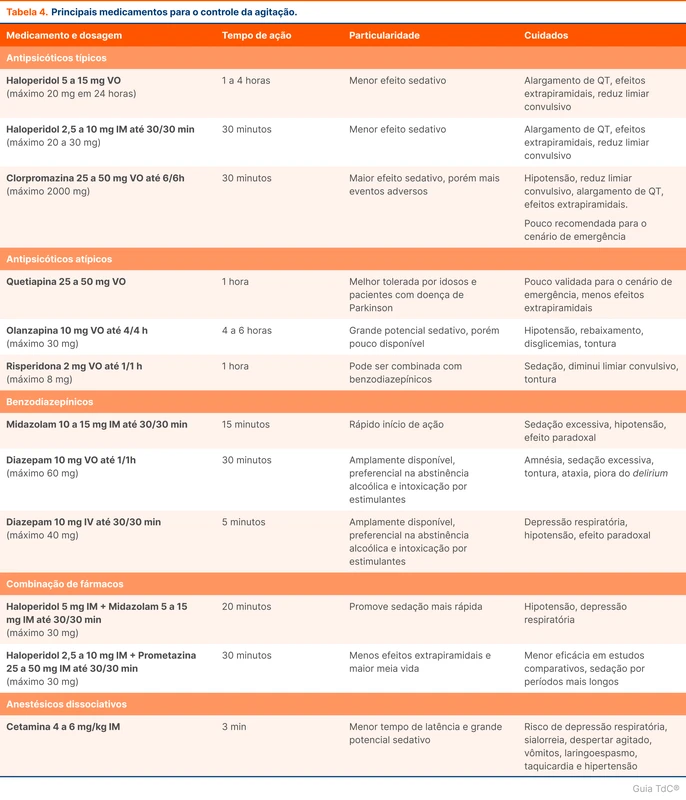
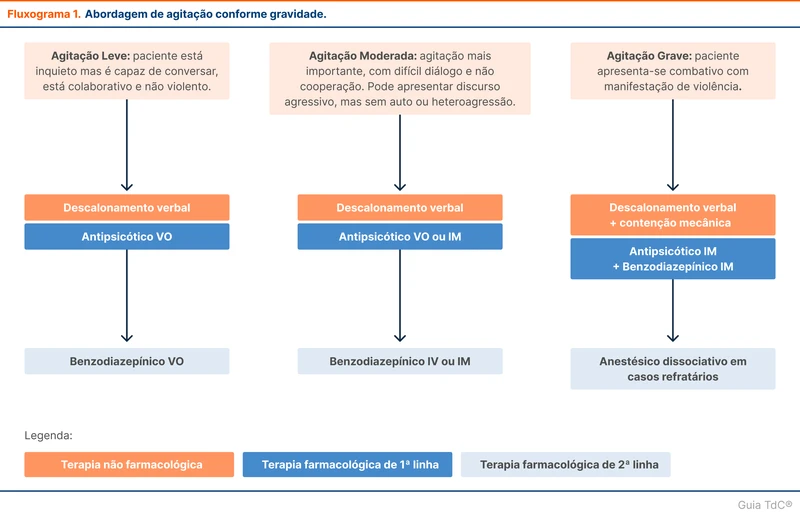
Insuficiência Adrenal Induzida por Corticoides e Desmame de Corticoides
A European Society of Endocrinology e a Endocrine Society publicaram uma diretriz de orientações para diagnóstico e tratamento de insuficiência adrenal induzida por corticoides em abril de 2024 [1]. Este tópico revisa o tema e como fazer o desmame de corticoides.
Quando desmamar corticoide?
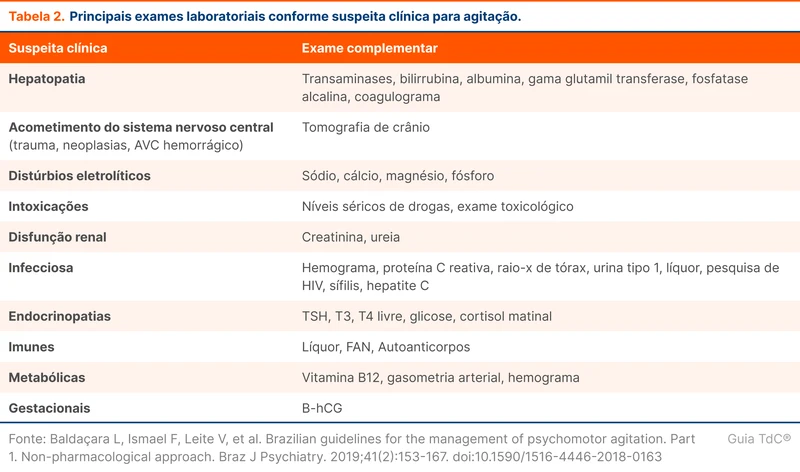
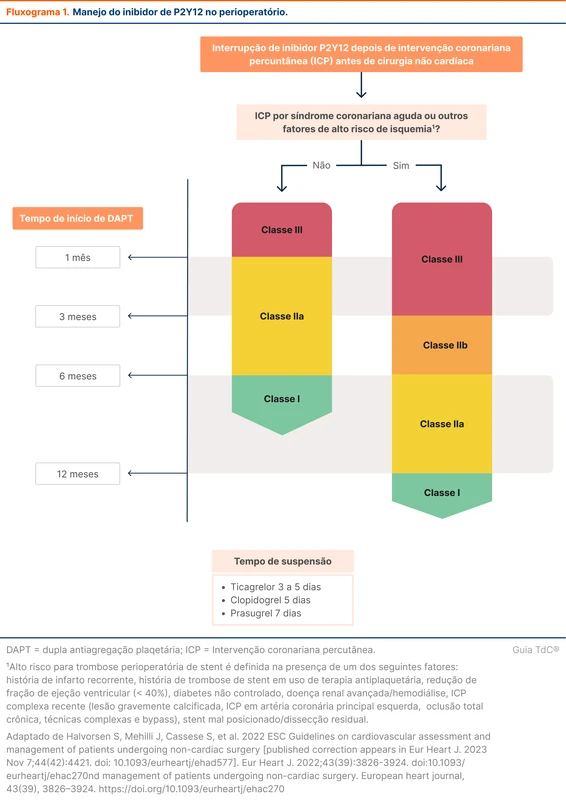
Corticoides exógenos podem causar insuficiência adrenal através da supressão do eixo hipotálamo-hipófise-adrenal. Qualquer dose de corticoide acima da dose equivalente à fisiológica tem o potencial de causar esse efeito. O grau de supressão é influenciado por dose acumulada, potência do corticoide e o tempo de uso. A tabela 1 traz os fatores de risco para desenvolvimento de insuficiência adrenal.
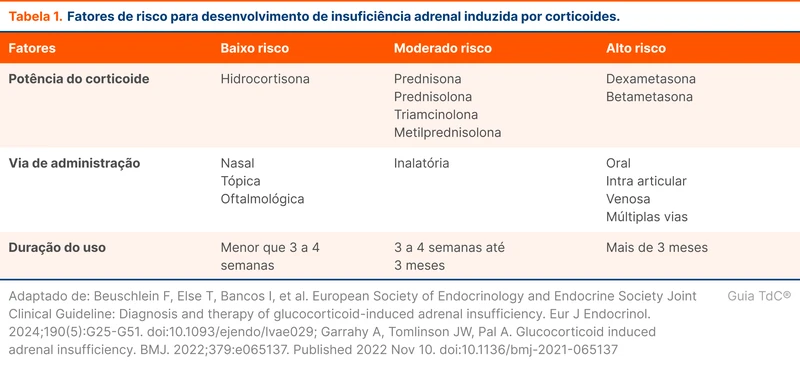
Qualquer via de administração, incluindo tópica e inalatória, pode levar à insuficiência adrenal [2-4].
Para evitar as consequências da insuficiência adrenal induzida por corticoides, alguns pacientes precisam que a medicação seja desmamada gradualmente. A decisão de suspender ou realizar o desmame envolve três fatores principais: controle da doença de base, tempo de uso e dose do corticoide. O controle da doença que motivou a introdução do corticoide é o gatilho para a decisão de desmamar a medicação.
A diretriz sugere não desmamar o corticoide quando o uso ocorreu por menos de três a quatro semanas, independentemente da dose. Nesses casos, a suspensão pode ser imediata e não requer testes para avaliar a função do eixo hipotálamo-hipófise-adrenal. O uso de corticoides deve ser abreviado quando possível, já que mesmo o uso curto está associado a aumento do risco de sepse, sangramento gastrointestinal, tromboembolismo venoso e fraturas [5].
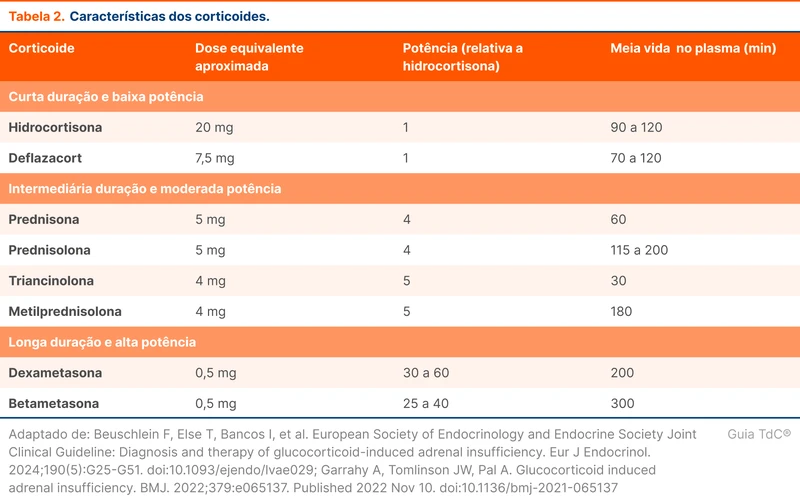
O uso por mais de três a quatro semanas sugere a necessidade de desmame. O risco de insuficiência adrenal é especialmente maior em doses suprafisiológicas, definidas como equivalentes ou superiores a 15 a 25 mg de hidrocortisona (5 a 7,5 mg de prednisona). A tabela 2 traz as principais características dos corticoides [1]. Veja mais em "Insuficiência Adrenal".
Como desmamar corticoide?
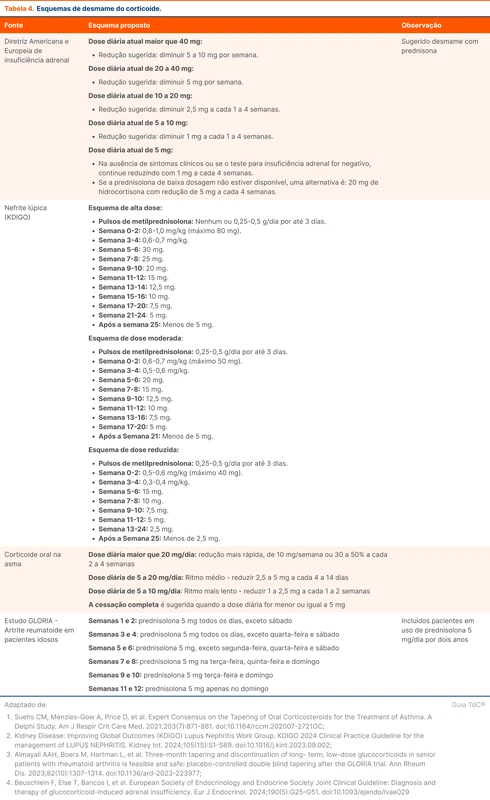
O processo de desmame pode ser dividido em duas etapas: a primeira, com redução até a dose fisiológica, equivalente a 5 a 7,5 mg de prednisona; e a segunda, com redução abaixo desse limiar. A conduta e complicações diferem entre as etapas.
Não existem evidências fortes que favoreçam um esquema específico de desmame. Modificações podem ser realizadas conforme a resposta de cada indivíduo. Pacientes com complicações induzidas por corticoide, como psicose, hipertensão e hiperglicemia, podem realizar desmame mais rápido até a dose fisiológica [1, 6].
Desmame até dose fisiológica (equivalente de prednisona 5 a 7,5 mg)
O primeiro passo é a troca do corticoide de longa duração para um corticoide de menor duração (tabela 2) — como a troca de dexametasona para prednisona, por exemplo. Mesmo após a redução para doses fisiológicas, os corticoides de longa duração estão mais associados a insuficiência adrenal e síndrome de Cushing exógeno.
Durante o desmame, deve-se monitorar sintomas de três condições: agudização da doença de base, insuficiência adrenal e abstinência de corticoide.
A síndrome de abstinência de corticoide é diferente de insuficiência adrenal induzida por corticoides. Os sintomas da abstinência de corticoide acontecem principalmente nas fases mais iniciais do desmame e são causados por dependência de concentrações suprafisiológicas e variação nas concentrações hormonais. Isso explica alguns sintomas relatados pelos pacientes durante o desmame quando ainda estão em doses suprafisiológicas. A tabela 3 resume as manifestações da abstinência de corticoides.
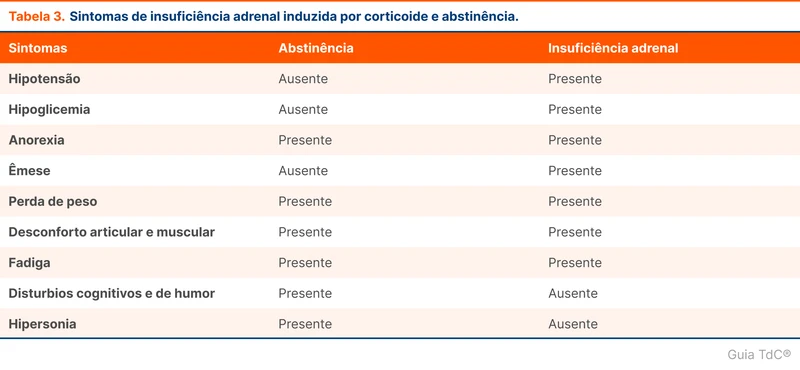
A diferenciação entre a síndrome de abstinência e a insuficiência adrenal é difícil devido à sobreposição dos sintomas. A dose de corticoide em uso é o principal parâmetro discriminante entre as condições, já que a insuficiência adrenal é improvável com uso em doses suprafisiológicas.
O reconhecimento da síndrome de abstinência é importante para evitar aumento de corticoide na presença de qualquer sintoma. Caso os sintomas de abstinência sejam graves, a diretriz sugere que a dose do corticoide pode ser aumentada temporariamente até a dose tolerada mais recente e realizar o desmame de forma mais gradual.
A tabela 4 traz o regime de desmame sugerido pela diretriz de insuficiência adrenal induzida por corticoide e outras possibilidades conforme a comorbidade de base.
Desmame de dose inferior à fisiológica (equivalente de prednisona menor que 5 a 7,5 mg)
Esta etapa do desmame exige atenção para identificação de insuficiência adrenal. Isso pode ser feito através de exames do cortisol matinal ou desmamando a medicação empiricamente e acompanhando o surgimento de sintomas.
A vigilância de sintomas de insuficiência adrenal permite o desmame do corticoide sem exames adicionais. Caso o paciente apresente um quadro clínico sugestivo, a dose anterior que não causou sintomas deve ser retomada.
Outra possibilidade é a dosagem de cortisol matinal, que pode ser utilizada para determinar a recuperação do eixo. Se a insuficiência adrenal for documentada (cortisol menor que 5 mcg/dL), a dose do corticoide deve ser mantida no limite inferior da dose fisiológica. Se os níveis de cortisol estiverem acima de 10 mcg/dL, pode-se suspender o uso de corticoides. O fluxograma 1 descreve as opções de desmame [6].
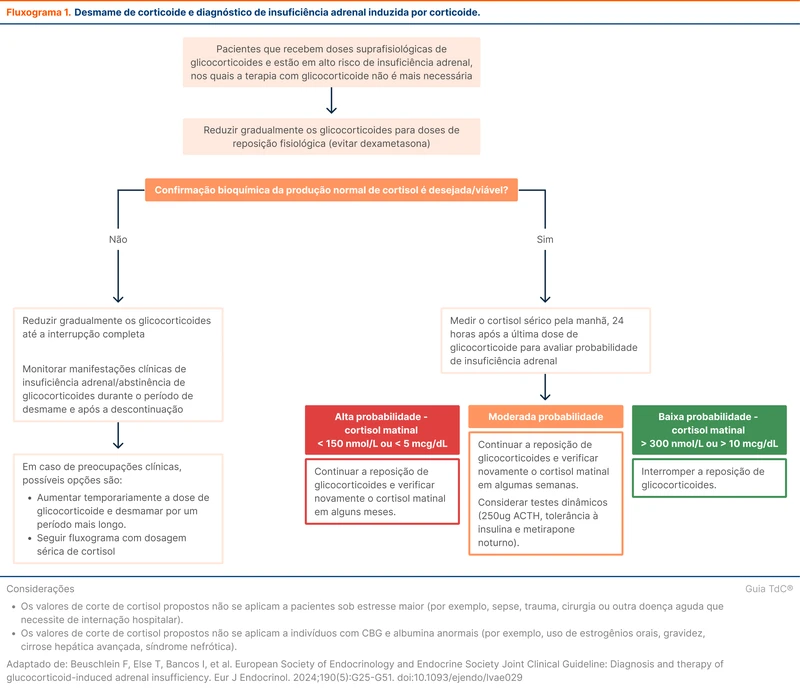
A diretriz reforça que os valores de cortisol são apenas guias e podem variar conforme os equipamentos de dosagem e divergem ligeiramente da abordagem descrita no tópico de insuficiência adrenal. Os valores também não se aplicam a pacientes com níveis anormais de albumina ou em situações de estresse agudo, como sepse, cirurgia ou trauma [6]. Veja mais em "Insuficiência Adrenal".
Não existem evidências que sugiram um melhor esquema para esta etapa do desmame. O estudo TOASST está em execução e se propõe a responder essa dúvida, além de comparar desmame gradual contra teste e suspensão abrupta em pacientes com doses de prednisona até 7,5 mg [7].
Como diagnosticar insuficiência adrenal induzida por corticoides?
Pacientes com sintomas durante o desmame ou que apresentam valores de cortisol matinal sugestivos de insuficiência adrenal devem manter a corticoterapia e ser reavaliados após meses para verificar a recuperação do eixo. Pacientes com sinais ou sintomas de síndrome de Cushing exógeno são considerados com supressão do eixo.
O tratamento da insuficiência adrenal induzida por corticoides consiste na reposição de corticoide em doses fisiológicas e na educação do paciente sobre o aumento da reposição em situações de estresse. Veja o material complementar sobre educação do paciente com insuficiência adrenal.
A reposição com fludrocortisona não está indicada, pois a função mineralocorticoide da adrenal está preservada na insuficiência adrenal induzida por corticoides.
Quando a recuperação do eixo não ocorre em cerca de um ano ou em pacientes que apresentaram crise adrenal, um endocrinologista deve ser consultado [1].