Doença Pulmonar Obstrutiva Crônica - GOLD 2023
Este tópico foi atualizado. Acesse "Atualização de DPOC: GOLD 2024" para ver as novidades.
Anualmente, o Global Initiative for Chronic Obstructive Lung Disease (GOLD) lança diretrizes de tratamento da doença pulmonar obstrutiva crônica (DPOC). A última revisão do ano de 2022 do Guia é sobre o GOLD 2023, revisando os conceitos importantes e trazendo as atualizações de DPOC [1].
Definição e impacto
A doença pulmonar obstrutiva crônica (DPOC) é a terceira causa mais comum de morte no mundo . Em 2012, 6% das mortes em todo o mundo foram por DPOC.
O GOLD define DPOC como:
"Condição pulmonar heterogênea caracterizada por sintomas crônicos em consequência de anormalidades na via aérea e/ou alvéolos levando a obstrução persistente e comumente progressiva no fluxo aéreo''.
Essa definição contém duas diferenças de DPOC e asma: obstrução persistente do fluxo aéreo (na asma a obstrução é variável) e anormalidades alveolares (na asma as alterações tendem a se restringir a via aérea).
O modelo tradicional de desenvolvimento da DPOC era de uma perda acelerada da função pulmonar induzida por fatores de risco - como tabagismo - em pessoas predispostas. Entende-se hoje que os pacientes também podem desenvolver DPOC por outra trajetória.
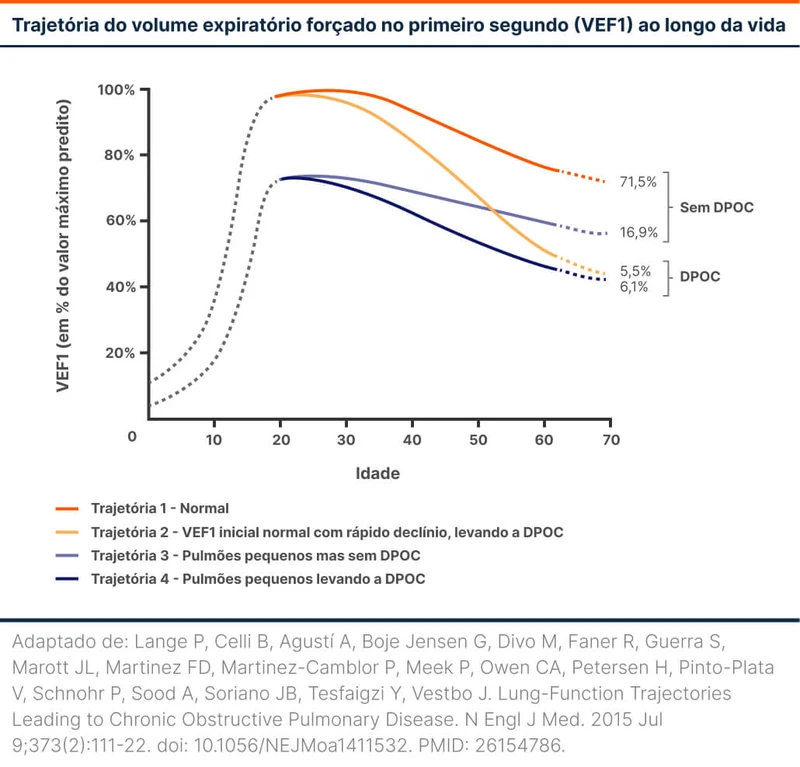
Algumas pessoas não tiveram o crescimento pulmonar normal e tem um pico de função pulmonar menor. Isso ocorre por problemas nos primeiros anos de vida (exposição intrauterina a agentes nocivos, baixo peso ao nascer, prematuridade, infecções respiratórias na infância e outros fatores). Mesmo perdendo função na velocidade habitual, podem acabar desenvolvendo DPOC se viverem o suficiente (veja figura 1).
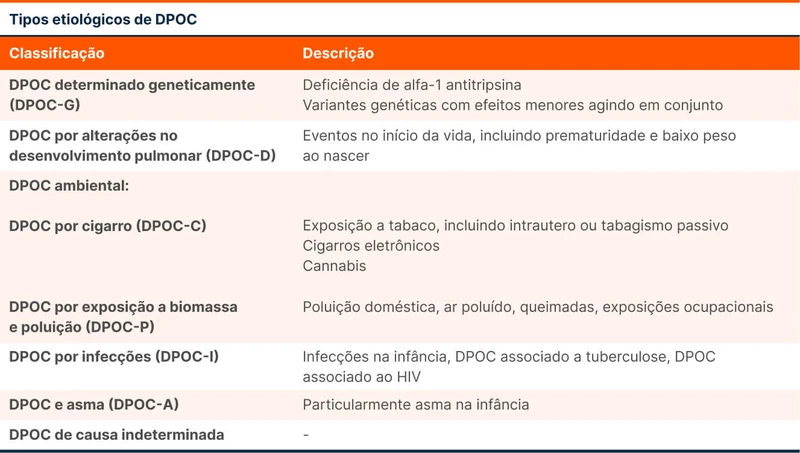
Essa perspectiva explica por que muitos pacientes desenvolvem DPOC sem nunca terem sido tabagistas. Diante de um quadro clínico sugestivo, a ausência de tabagismo não exclui a possibilidade de DPOC. O GOLD propõe uma divisão dos tipos de DPOC de acordo com sua etiologia, conforme a tabela 1.
Diagnóstico
A espirometria é mandatória para o diagnóstico de DPOC. As indicações clínicas para considerar DPOC e realizar espirometria estão na tabela 2.

Tosse crônica é um indicativo de DPOC, mesmo sem secreção. Secreção excessiva deve levantar a suspeita de bronquiectasia. Crises de tosse podem causar síncope ou fraturas de arcos costais.
Alguns pacientes sem diagnóstico se apresentam em uma exacerbação. Nesses casos, a hipótese de DPOC deve ser levantada especialmente na presença de fatores de risco. Alguns relatam que tem resfriados/gripes prolongadas e mais intensas que as outras pessoas, um relato que também é suspeito para DPOC em pessoas de risco.
O rótulo de "DPOC presumido", assumindo o diagnóstico apenas com base em dados clínicos, é perigoso e deve ser temporário. Estudos mostram que muitos pacientes não realizam espirometria após a suspeita de DPOC [2]. A história e o exame físico não são bons preditores de obstrução ao fluxo de ar na espirometria [3]. Muitos pacientes tratados para DPOC sem espirometria não tem obstrução de fluxo de ar quando realizam o exame [4].
O exame físico ajuda pouco no diagnóstico. Os sinais de obstrução ao fluxo aéreo estão presentes apenas em casos avançados. A ausência desses sinais não exclui a possibilidade de DPOC.

Os diagnósticos diferenciais principais estão na tabela 3. A diferenciação mais difícil é com asma. Asma e DPOC podem estar presentes no mesmo paciente. O termo ACOS - denotando uma sobreposição entre asma e DPOC - não deve ser mais utilizado.
Espirometria
Deve-se utilizar os resultados de velocidade expiratória forçada no primeiro segundo (VEF1) e capacidade vital forçada (CVF) na relação VEF1/CVF. Os valores utilizados devem ser obtidos após a administração de broncodilatador.
O critério espirométrico permanece o mesmo. Uma relação VEF1/CVF pós broncodilatador menor que 0,7 é diagnóstica de obstrução ao fluxo de ar não totalmente reversível. Esse achado não é específico de DPOC, podem ocorrer na asma e em outras doenças pulmonares.
O GOLD introduz dois conceitos novos de condições precursoras de DPOC: pré-DPOC e PRISm. Pré-DPOC são pessoas com sintomas respiratórios e/ou alterações estruturais pulmonares (ex.: enfisema em tomografia) e/ou alterações fisiológicas (ex.: VEF1 reduzido), mas com a relação VEF1/CVF preservada. PRISm - do inglês Preserved Ratio Impaired Spirometry - agrupa pessoas com espirometria alterada, mas VEF1/CVF normal. Essas pessoas têm risco de evoluírem para DPOC, mas nem todas evoluem. Mais estudos são necessários para caracterizar melhor a história natural desses grupos.
DPOC estável: avaliação e classificação
Após o diagnóstico, três pontos devem ser avaliados:
- Gravidade da obstrução ao fluxo de ar
- Risco de exacerbações
- Intensidade dos sintomas

A obstrução ao fluxo de ar é avaliada pela VEF1 após o broncodilatador em porcentagem em relação ao predito. O paciente então é classificado conforme a tabela 4. A espirometria deve ser repetida anualmente.
A avaliação clínica dos pacientes mudou. Antes, risco de exacerbações (alto/baixo) e intensidade dos sintomas (alta/baixa) se combinavam em quatro grupos (A, B, C e D) para guiar o tratamento.
Considerando a relevância clínica das exacerbações, a orientação agora é primeiro avaliar o risco delas acontecerem. Se o paciente for de alto risco - pelo menos uma exacerbação com hospitalização ou duas idas ao pronto socorro - ele está na categoria E.

Se o risco de exacerbações for baixo, aí avalia-se a intensidade dos sintomas. Se a intensidade for alta - questionário mMRC ≥ 2 ou CAT ≥ 10 - o paciente está na categoria B. Se a intensidade for baixa, está na categoria A.
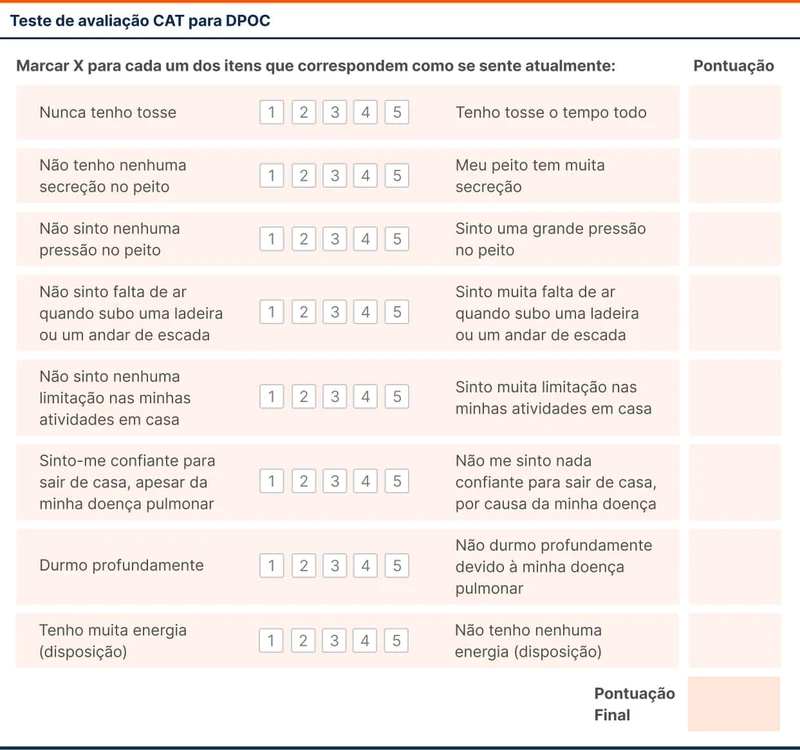
A saturação de oxigênio deve ser aferida em toda consulta. Se ≤ 92%, deve-se solicitar uma gasometria arterial.
Tomografia de tórax deve ser considerada nas seguintes situações:
- Exacerbações frequentes, com tosse intensa e produção excessiva de secreção - pelo diagnóstico diferencial com bronquiectasia.
- Sintomas desproporcionais ao achados da prova de função pulmonar.
- VEF1 < 45% do predito e candidatos a intervenção cirúrgica - cirurgia redutora de volume pulmonar é uma opção para pacientes com hiperinsuflação e enfisema predominando nos lobos superiores.
- Pacientes que entram no critério de rastreio de câncer de pulmão.
Todo paciente com DPOC deve ser rastreado uma vez para deficiência de alfa-1 antitripsina.
DPOC estável: terapia não farmacológica
As principais intervenções não farmacológicas de DPOC estável são:
- Cessar o tabagismo
- Vacinas
- Reabilitação pulmonar
- Oxigenoterapia domiciliar
- Ventilação não invasiva
- Cirurgias
Todo paciente tabagista com DPOC deve ser aconselhado a cessar o tabagismo. Um programa de cessação tabagismo com disponibilidade de medicações deve ser oferecido. Para mais informações, ouça Episódio 11: Tabagismo. Outros fatores de risco como fogão a lenha, ambientes mal ventilados e poluição devem ser abordados e, se possível, afastados do paciente.
O GOLD recomenda vacinas para os seguintes agentes, a depender das diretrizes locais: influenza, Sars-CoV-2, pneumococo, coqueluche (dTPa, para aqueles não vacinados na infância), zoster (se mais de 50 anos). Para saber mais sobre a vacina de penumococo, acesse "Vacina Pneumocócica no Adulto".
A reabilitação pulmonar é uma intervenção ampla que envolve treinamento com exercícios, educação e auto-manejo. A reabilitação reduz desfechos significativos, incluindo mortalidade e hospitalizações. O benefício maior é em pacientes com exacerbações. A terapia está indicada em DPOC GOLD B e E.
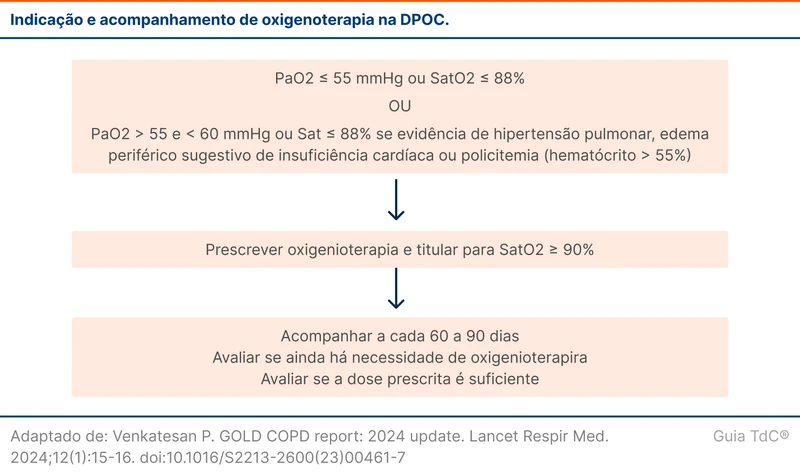
A oxigenoterapia domiciliar é capaz de reduzir a mortalidade. Os critérios e o seguimento estão sumarizados no fluxograma 1. A reavaliação em 60 a 90 dias é necessária, pois muitos pacientes saem do critério após algumas semanas.
Ventilação não invasiva (VNI), sempre lembrada nas exacerbações, pode ser utilizada em casos selecionados de DPOC estável. Os pacientes que podem se beneficiar são aqueles com hospitalização recente e hipercapnia persistente (pCO2 > 53 mmHg).
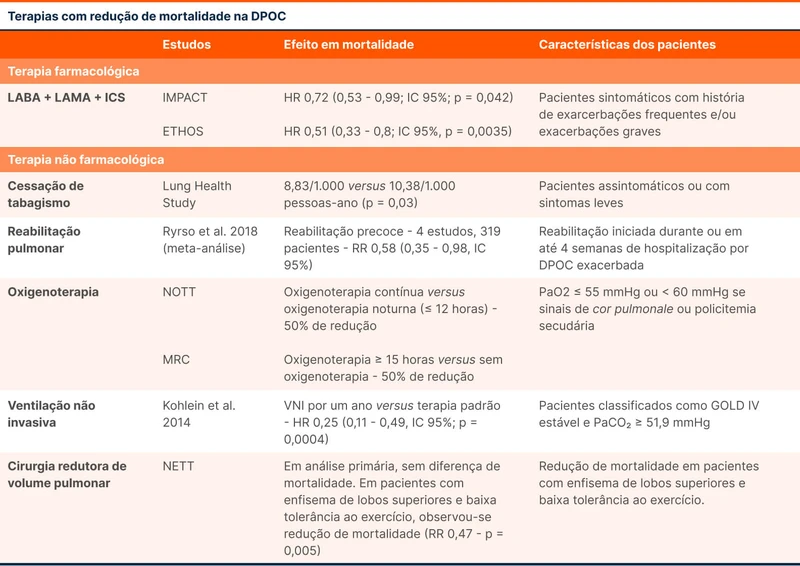
Intervenções cirúrgicas e broncoscópicas são opções para alguns pacientes com DPOC. A cirurgia mais respaldada é a cirurgia de redução dos volumes pulmonares, indicada para pacientes com predomínio de enfisema em lobo superior. Esse tipo de cirurgia pode reduzir a mortalidade. A colocação de válvulas endobrônquicas unidirecionais é uma alternativa em pacientes com enfisema grave. O transplante de pulmão pode ser realizado na DPOC avançada, pesando risco de complicações e disponibilidades de órgãos.
DPOC estável: medicações iniciais
Não existem ensaios clínicos randomizados para guiar o início da terapia. O GOLD propõe dois algoritmos, um para início e outro para ajuste medicamentoso. O início da terapia é guiado pela classificação A, B e E.

Pacientes do grupo A - pouco sintomáticos e com baixo risco de exacerbação - devem usar um broncodilatador, seja beta agonista ou antimuscarínico. Drogas de longa ou curta ação podem ser usadas, mas a de longa ação são preferíveis.
Pacientes do grupo B - muito sintomáticos e com baixo risco de exacerbação - devem usar um beta agonista de longa ação (LABA) e um antimuscarínico de longa ação (LAMA) associados. O estudo EMAX encontrou superioridade da combinação LABA+LAMA em relação ao LAMA em vários desfechos [5]. Se a combinação não for possível, um LABA ou LAMA podem ser usados isoladamente, sem evidência de superioridade de um sobre o outro. As coortes mostram que esses pacientes comumente têm comorbidades que pioram os sintomas e estas devem ser pesquisadas ativamente.
Pacientes do grupo E - alto risco de exacerbação, independente de sintomas - devem usar uma combinação de LABA+LAMA. Essa combinação garante maior redução de exacerbações.
Para pacientes do grupo E, se os eosinófilos forem maiores que 300 células/mcL, deve-se considerar iniciar já com a tripla terapia contendo corticoide inalatório (ICS), LABA e LAMA. Os ICS não têm papel na redução de sintomas de DPOC, mas podem ajudar alguns pacientes a terem menos exacerbações. Existe uma relação direta entre o benefício dos ICS e a contagem de eosinófilos no sangue.
A combinação de LABA e ICS, muito utilizada na asma, é desencorajada na DPOC. Se existe possibilidade de benefício com ICS, a combinação de ICS+LABA+LAMA deve ser prescrita. Se um paciente tem asma e DPOC ao mesmo tempo, deve-se seguir primariamente a linha de tratamento da asma. Nesses casos, o tratamento sempre deve conter um ICS.
DPOC estável: medicações adicionais
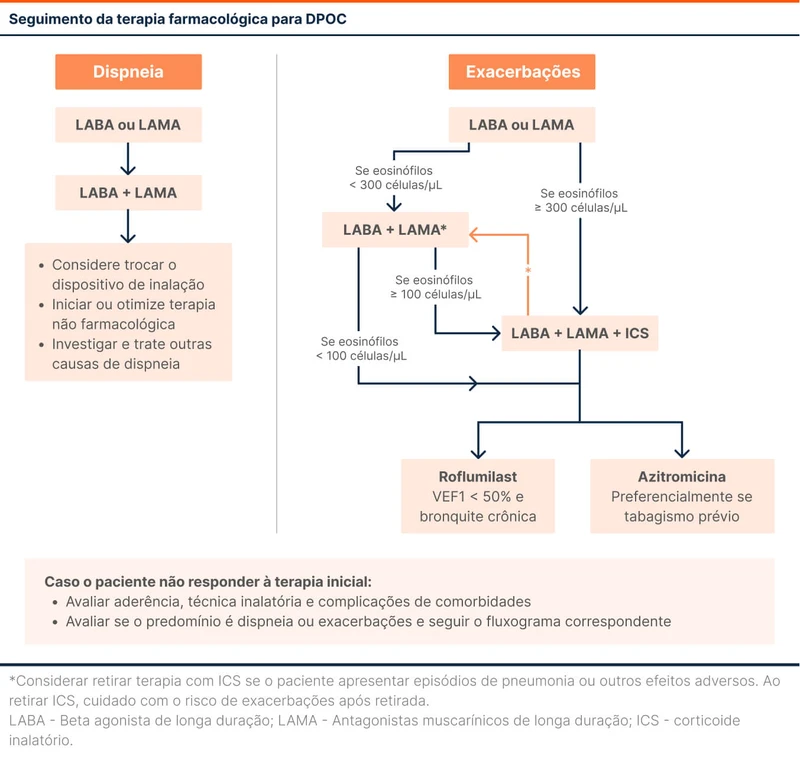
O ajuste medicamentoso depende do componente que está persistindo apesar do tratamento: os sintomas (especialmente a dispneia) ou as exacerbações. Em todos os casos, o primeiro passo é sempre checar aderência, técnica de uso dos dispositivos inalatórios e presença de comorbidades.
Se o paciente persiste com dispneia, deve-se associar LABA+LAMA. Se mesmo assim persistir, as opções são:
- Combinar as medicações em um único dispositivo
- Trocar o dispositivo inalatório
- Instituir ou escalonar tratamentos não farmacológicos
- Investigar outras causas de dispneia
Se o paciente persiste com exacerbações, deve-se checar a contagem de eosinófilos e se > 300 células/mcL prescrever a associação ICS+LABA+LAMA. Se os eosinófilos forem < 300 células/mcL, a orientação é associar LABA+LAMA. Se mesmo com a associação LABA+LAMA o paciente tem exacerbações, vale a tentativa de ICS+LABA+LAMA se eosinófilos> 100 células/mcL.
Alguns pacientes continuam tendo exacerbações mesmo com tripla terapia de ICS+LABA+LAMA ou com LABA+LAMA e eosinófilos < 100 células/mcL. Nesse cenário, existem duas opções. Para aqueles com VEF1 < 50% do predito e com bronquite crônica (tosse produtiva por pelo menos 3 meses por ano em dois anos consecutivos), está indicada a adição de inibidor de fosfodiesterase-4 como o roflumilaste. Outra opção, esta para aqueles com DPOC por tabagismo, é acrescentar azitromicina 500mg três vezes por semana.
Os ICS, apesar de reduzirem exacerbações, aumentam o risco de pneumonia. Se após a introdução do ICS começarem a ocorrer pneumonias, deve-se suspender o ICS. Em pacientes com eosinófilos > 300 células/mcL, existe maior risco de exacerbações após a retirada do ICS.
DPOC exacerbado: avaliação
O GOLD 2023 define uma exacerbação de DPOC como:
"piora da dispneia e/ou tosse com secreção que ocorre em menos de 14 dias que pode ser acompanhada por taquipneia e/ou taquicardia comumente associada a aumento da inflamação local e sistêmica causada por infecção, poluição ou outros insultos".
O quadro de exacerbação de DPOC é inespecífico. Os diagnósticos diferenciais mais comuns são pneumonia, insuficiência cardíaca e embolia pulmonar. Os três devem ser procurados ativamente.
Muitos pacientes com tromboembolismo pulmonar (TEP) tem apresentação clínica similar a exacerbação de DPOC. Eles podem ter queixas respiratórias, hipoxemia e imagem pulmonar sem imagem sugestiva de pneumonia. Deve-se desconfiar de TEP em exacerbações com pouca secreção, hipoxemia e ausência de melhora.
O GOLD recomenda dosar a proteína C reativa em pacientes com suspeita de exacerbação de DPOC. Além de ajudar na decisão de iniciar antibióticos, quando está menor que 10 mg/L se associa com exacerbações mais leves (veja o tópico "Antibióticos para DPOC Exacerbada").
Os sintomas mais intensos de exacerbação duram de 7 a 10 dias. Em 8 semanas, até 20% dos pacientes ainda não se recuperaram completamente.
DPOC exacerbado: tratamento
A primeira medida válida para todas as exacerbações é o uso de broncodilatadores de curta ação. Beta agonistas (SABA), com ou sem antimuscarínicos (SAMA), devem ser usados. Mesmo com a adição dos agentes de curta ação, não se deve suspender os agentes de longa ação caso o paciente já fizesse uso (apesar que isso nunca foi estudado). Se o paciente não usava agentes de longa ação, estes devem ser adicionados sempre antes da alta hospitalar.
Os corticóides sistêmicos podem reduzir o tempo de recuperação, abreviar a internação, diminuir a chance de recorrência e melhorar a oxigenação. Esses resultados foram obtidos principalmente em pacientes tratados dentro do hospital. A dose é de 40mg de prednisona por 05 dias.
O GOLD recomenda o uso de antibióticos nas seguintes situações:
- Presença de purulência do escarro e pelo menos um dos critérios a seguir: piora da dispneia e aumento do volume do escarro.
- Necessidade de ventilação mecânica invasiva ou não invasiva.
O tempo de antibiótico é de 5 a 7 dias, preferindo 5 dias em pacientes fora do hospital. A escolha inicial do antibiótico envolve amoxicilina/clavulanato ou macrolídeo. Deve-se coletar cultura do escarro em pacientes com exacerbações frequentes, limitação grave ao fluxo de ar ou necessidade de ventilação mecânica. Há maior chance de bactérias resistentes nessas situações.
A ventilação não invasiva é a estratégia ventilatória preferencial em DPOC exacerbada. A taxa de sucesso é de 80 a 85%. A VNI reduz a mortalidade na DPOC exacerbada. As indicações estão na tabela 8. Se o paciente tolera 4 horas sem VNI, já pode suspender sem necessidade de desmame.

Além de condição clínica em deterioração, o GOLD recomenda admissão em UTI para pacientes com pO2 menor que 40 e acidose respiratória com pH menor que 7,25.
Após a alta, orienta-se um retorno entre 1 semana e 1 mês e um segundo retorno entre 3 a 4 meses.
